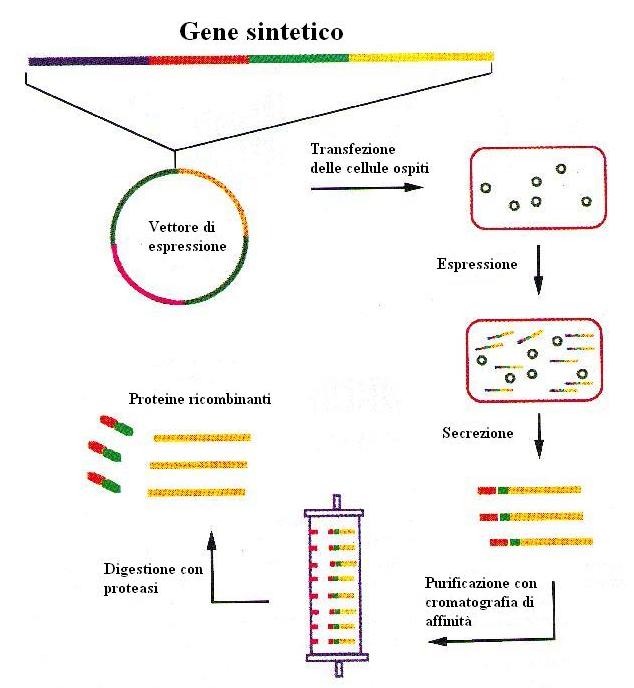
La fase fondamentale per l’ottenimento delle proteine ricombinanti è quella del clonaggio del gene codificante la proteina d’interesse, in vettori di espressione. Vengono impiegati vettori che codificheranno per proteine di fusione. Questo è possibile per la presenza nel vettore, di una sequenza nucleotidica codificante per una regione proteica che si troverà all’N-terminale o al C-terminale delle proteine ottenute (in base a dove è posizionata). Questa regione anche detta Tag (etichetta), faciliterà in seguito il riconoscimento e la purificazione delle proteine ricombinanti. Con questi vettori viene poi trasformato il sistema cellulare prescelto ed in questo modo si otterranno grandi quantità di proteine ricombinanti. Queste proteine potranno poi essere purificate attraverso apposite tecniche ed individuate con esperimenti di western blot. In seguito la regione tag potrà essere rimossa utilizzando apposite proteasi.
In base al tipo di vettore utilizzato le proteine verranno taggate (marcate) con epitopi diversi: Coda di istidine, ottapeptide FLAG, gene GST. In base al tipo di tag che avranno le proteine, dovrà essere utilizzato il tipo di purificazione adatto. Se le proteine hanno la coda di istidine verrà utilizzata una cromatografia di affinità con colonnine di nichel. In presenza del FLAG dovranno essere utilizzati anticorpo Anti-Flag immobilizzati.
Molto importante è anche la scelta del sistema di espressione, cioè del tipo cellullare o del modello animale che si vuole utilizzare come produttore di proteine ricombinanti. Molto impiegati sono: batteri (E. coli), lieviti (S. cerevisiae; P. pastoris), cellule animali (cellule di insetto; cellule di mammifero), modelli animali (mucche; pecore), modelli vegetali. La scelta del sistema cellulare dipende dal tipo di proteina ricombinante che si vuole ottenere. Gli organismi procarioti non attuano alcune modifiche post-traduzionali tipiche degli eucarioti, per cui se ciò è richiesto occorre scegliere cellule eucarioti.
In rete è possibile trovare molto materiale a riguardo, ecco solo alcuni dei link:
http://www.molecularlab.it/post-genomica/proteomica/index.asp
http://www.bio.mtu.edu/campbell/purifica.htm