In Termodinamica si studiano le trasformazioni dei sistemi fisici, dove per trasformazione si intende il cambiamento delle caratteristiche del sistema al passare del tempo, sia cambiamenti sollecitati che spontanei. In particolare, la Termodinamica dell’equilibrio studia il cambiamento dei sistemi tra stati di equilibrio, cioè stati che se lasciati imperturbati restano immutati nel tempo.
Prima di andare avanti è necessario spiegare i diversi tipi di proprietà di equilibrio che un sistema può avere.
-
Si definisce equilibrio vero e proprio lo stato di un sistema che resta inalterato nel tempo se non viene perturbato, in particolare i sistemi in natura presentano equilibri stabili, cioè che vengono recuperati quando il sistema viene debolmente perturbato. Per i sistemi termodinamici l’equilibrio si realizza quando i valori dei parametri intensivi (per esempio pressione, temperatura e densità nel caso di un gas) sono uguali in ogni punto del sistema e uguali ai valori dell’ambiente circostante. Per tale motivo questa condizione di equilibrio è anche chiamata esoequilibrio. Le definizioni che seguono sono ispirate a questa (uguaglianza dei parametri intensivi) con qualche modifica, il che rende tali stati non di equilibrio (non sono immutabili nel tempo anche con il sistema imperturbato).
-
Si parla di endoequilibrio quando il sistema presenta valori uguali in ogni punto dei parametri intensivi ma questi valori sono diversi da quelli dell’ambiente circostante. È il caso di una casa riscaldata a 25°C mentre l’esterno della casa è a 4°C. Uno stato del genere può essere mantenuto immutato solo se c’è un’azione diretta da parte di qualche macchina termica (nel caso della casa c’è il sistema di riscaldamento), in tal caso si parla di stato stazionario di non equilibrio. Altrimenti con il passare del tempo i parametri intensivi del sistema cambiano fino ad allinearsi con quelli dell’ambiente esterno. Questi stati possono essere descritti tramite equazioni di stato come quelli di equilibrio vero e proprio, e di fatto solo un’analisi esterna al sistema (che riguardi gli scambi di energia con l’ambiente) può distinguere uno stato di endoequilibrio da uno di esoequilibrio. Naturalmente ogni stato di esoequilibrio è anche di endoequilibrio ma non è sempre vero il contrario.
-
Si parla di equilibrio locale quando i parametri intensivi non sono uguali nei diversi punti del sistema, ma intorno ad ogni punto si può individuare un volume abbastanza piccolo da poter considerare tale volume in endoequilibrio e allo stesso tempo contenente un numero abbastanza grande di costituenti microscopici (atomi, molecole, particelle, etc.). Un esempio è una stanza in cui vi siano dei recipienti contenenti acqua calda e altri con ghiaccio. In tal caso la temperatura complessiva non è definita, ma si può parlare di temperatura locale, relativa a ciascun punto della stanza. Anche in questo caso lo stato di non equilibrio può essere mantenuto artificialmente oppure lasciato a sé stesso il sistema evolverà verso l’equilibrio. Non esiste un’equazione di stato ma essa può essere applicata a ciascun volumetto separatamente. Naturalmente ogni stato di endoequilibrio possiede anche la proprietà di equilibrio locale, ma non è vero il viceversa.
Risultati sperimentali e di simulazione numerica dimostrano che, anche partendo da sistemi in stati così estremi da non soddisfare neanche la condizione di equilibrio locale, quest’ultimo viene raggiunto in tempi talmente brevi che non commettiamo alcun errore se stabiliamo che ogni sistema naturale si trovi in uno dei tre stati appena descritti, senza ulteriori alternative.
Nell’ambito delle trasformazioni tra stati di equilibrio la Termodinamica studia con attenzione le cosidette quasi statiche, che sono quelle trasformazioni in cui il sistema è, istante per istante, in endoequilibrio. Solo una trasformazione molto lenta può permettere ad un sistema di mantenere omogenei nel suo volume i valori dei parametri intensivi. Se oltre alla condizione di endoequilibrio si realizza anche, istante per istante, quella di esoequilibrio, la trasformazione è detta reversibile, perché in tal caso essa può essere realizzata in entrambi i versi dato che ogni stato intermedio è invariante se non perturbato e quindi tramite perturbazioni infinitesime possiamo decidere in che direzione far evolvere il tutto.
Le trasformazioni reversibili sono molto importanti per tutta una serie di motivi tra cui il fatto che tutti gli stati intermedi sono analoghi a stati di equilibrio immutabile e quindi possono essere descritti facilmente con pochi parametri (questo vale per tutte le quasistatiche) e inoltre possono essere usate per calcolare la variazione di entropia, cioè di disordine, tra due stati di equilibrio, anche se questi due stati sono in realtà collegati da una trasformazione non reversibile.
Chiaramente una trasformazione irreversibile è una trasformazione non reversibile, e questo significa che durante la trasformazione il sistema attraversa stati di endoequilibrio (ma non esoequilibrio) o addirittura di equilibrio locale (ma non endoequilibrio). Dal punto di vista macroscopico l’unica differenza è questa, cioè la presenza di differenze nei parametri intensivi tra sistema e ambiente o addirittura all’interno dello stesso sistema.
Se tuttavia andiamo ad analizzare cosa accade all’entropia vediamo che le differenze crescono enormemente.
Sappiamo che la variazione di entropia tra uno stato ed un altro di un sistema è data dall’integrale di Clausius
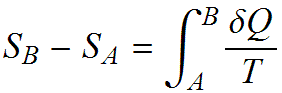
eseguito su una qualunque trasformazione reversibile che colleghi lo stato iniziale A a quello finale B e in cui T è la temperatura dell’oggetto con cui si scambia la quantità di calore ðQ. Vogliamo analizzare cosa accade all’entropia totale (sistema+ambiente) nei diversi tipi di trasformazione. In generale la variazione di entropia totale è data dalla variazione di entropia del sistema sommata a quella dell’ambiente
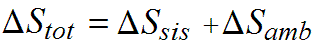
In una trasformazione reversibile la variazione di entropia è facilmente calcolabile usando proprio la trasformazione in esame, essendo essa reversibile. Il sistema e l’ambiente sono alla stessa temperatura, gli unici scambi di calore che avvengono sono tra sistema e ambiente ed essi sono naturalmente sempre uguali ma di segno opposto (perché uno dei due cede mentre l’altro assorbe). Quindi l’integrale di Clausius per il sistema e quello per l’ambiente hanno l’integrando, passo per passo, uguale in modulo ed opposto in segno. Alla fine quindi le variazioni di entropia dell’ambiente e del sistema saranno uguali e opposte in segno. L’entropia totale dell’universo non è cambiata. Se si riesce a compiere un ciclo di trasformazioni reversibili sia il sistema che l’ambiente tornano nello stato iniziale.
In una trasformazione quasistatica non reversibile le cose vanno un po’ diversamente perché stavolta sistema e ambiente non sono in equilibrio tra loro e quindi non possiamo usare la stessa trasformazione fittizia per calcolare le due variazioni di entropia. Per fissare le idee immaginiamo di considerare un pezzo di metallo caldo che lentamente (in modo che la temperatura sia omogenea all’interno del volume del metallo) si raffredda, raggiungendo la temperatura ambiente, che possiamo considerare immutabile nel tempo essendo l’ambiente troppo grande perché la sua temperatura si modifichi in conseguenza degli scambi di calore con il metallo. Per calcolare la variazione di entropia del metallo dobbiamo usare una trasformazione in cui il metallo è a contatto con un termostato che lentamente gli sottrae calore, rimanendo sempre in equilibrio con esso, e portandolo dalla temperatura iniziale a quella dell’ambiente. L’integrale di Clausius per il sistema è quindi dato dalla somma di tante frazioni ciascuna con un denominatore diverso (la temperatura varia ad ogni passo della trasformazione). D’altra parte per calcolare la variazione di entropia dell’ambiente dobbiamo considerare una trasformazione in cui l’ambiente assorbe calore da un termostato che si trova alla sua stessa temperatura. L’integrale di Clausius dell’ambiente è dato dalla somma di tante frazioni tutte con lo stesso denominatore (la temperatura è costante ad ogni passo della trasformazione). I numeratori invece sono uguali e opposti in segno a quelli del metallo, perché anche in questo caso uno dei due (l’ambiente) assorbe tutto il calore ceduto dall’altro (il metallo). Quindi l’integrando per l’ambiente è sempre numericamente più grande dell’integrando per il metallo e quindi anche se quest’ultimo è negativo la variazione di entropia dell’ambiente sarà numericamente più grande di quella del metallo. In altre parole la diminuzione di entropia del metallo non è sufficiente a compensare l’aumento di entropia dell’ambiente. L’entropia totale dell’universo è aumentata. Sorprendentemente (per chi non conosce il II principio della Termodinamica, naturalmente) si ottiene lo stesso risultato se si considera il processo speculare di un oggetto più freddo dell’ambiente che si riscalda spontaneamente. Quindi se si compie un ciclo di trasformazioni quasistatiche irreversibili il sistema torna nello stato iniziale (per definizione di ciclo) e quindi la sua entropia non deve variare, dovendo aumentare quella totale necessariamente sarà aumentata quella dell’ambiente che quindi non ritornerà nello stato iniziale.
In una trasformazione irreversibile in cui il sistema non è neanche in endoequilibrio (ma solo in equilibrio locale) nuovamente si instaurano processi irreversibili tra sistema e ambiente ma stavolta anche tra parti diverse all’interno del sistema. Abbiamo quindi una situazione simile a quella descritta sopra con la differenza che l’aumento dell’entropia non va valutato solo considerando gli scambi di calore tra sistema e ambiente ma anche gli scambi di calore tra i diversi volumetti in cui dobbiamo suddividere il sistema per poter definire i parametri intensivi locali. Questo naturalmente comporta un aumento dell’entropia dell’universo maggiore che nel caso precedente. Come prima un ciclo di trasformazioni irreversibili non quasistatiche riporta il sistema nello stato iniziale ma l’ambiente cambia stato avendo aumentato la propria entropia. Questo sembra strano perché in questo caso l’entropia viene prodotta anche all’interno del sistema. Ma questo significa solo che questo ulteriore surplus di entropia prodotta viene comunque scaricato nell’ambiente dai processi interni che riportano il sistema nello stato iniziale.
L’analisi di questi ultimi due casi ci fa capire quindi che ogni processo irreversibile produce nuova entropia che si va ad aggiungere a quella già esistente nell’universo. Mentre la diminuzione di entropia di un sistema può avvenire solo per travaso della sua entropia in un altro sistema, l’aumento dell’entropia può avvenire anche per la creazione di altra entropia. È questo a determinare il continuo aumento dell’entropia totale e a determinare la freccia termodinamica del tempo.