La comunicazione tra cellule schematicamente può essere riassunta in tre fasi: la cellula segnalante produce ed invia una molecola segnale, la cellula bersaglio la intercetta tramite delle strutture specifiche dette recettori ed elabora una risposta. Tutti i meccanismi attuati dalla cellula per convertire il segnale ricevuto in una risposta vengono genericamente definiti trasduzione del segnale. La prima basilare distinzione tra i vari tipi di comunicazione cellulare viene fatta in base alla localizzazione del recettore, intracellulare o sulla superficie della cellula; in quest’ultimo caso si ha un’ulteriore divisione in recettori legati a proteine canale, recettori associati ad enzimi e recettori accoppiati a proteine G.
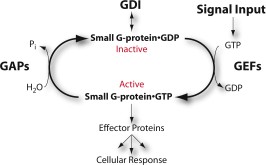
Le proteine G, siano esse monomeriche o trimeriche, sono GTPasi, cioè idrolizzano GTP a GDP. Normalmente la proteina G è inattiva e lega GDP, ma quando il recettore lega la molecola segnale, cambia conformazione e promuove lo scambio di GDP con GTP; la proteina G si attiva e resta tale finchè il GTP non viene idrolizzato a GDP. Molti di questi recettori controllano meccanismi che regolano la concentrazione di uno o più piccole molecole intracellulari, dette secondi messaggeri, fra cui i più comuni sono l’AMP ciclico (cAMP) e il Ca2+.
Il cAMP è sintetizzato da un enzima legato alla membrana plasmatica attivato dalla proteina G, l’adenilato ciclasi, secondo la reazione: ATP → cAMP + PPi , mentre è degradato dalla cAMP fosfodiesterasi (cAMP → AMP), per cui la concentrazione in cellula di cAMP è data dal bilancio delle due attività. Questo punto della trasduzione del segnale è cruciale per la diversificazione delle risposte, poichè in cellule di diversi tessuti la stessa molecola può modificare diversamente la concentrazione di cAMP e quindi portare a differenti risposte; allo stesso modo, diverse molecole possono avere lo stesso effetto a seconda del tessuto.
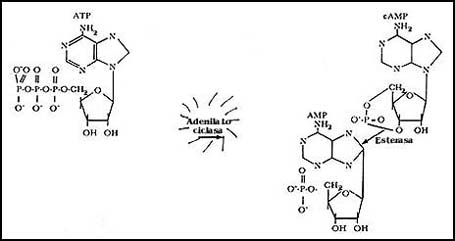
Da: http://omega.ilce.edu.mx:3000/sites/ciencia/volumen1/ciencia2/18/imgs/fig41p106.jpg
Le variazioni di concentrazione di cAMP influenzano principalmente l’attività di un altro enzima, la chinasi A (PKA), che catalizza il trasferimento gruppo fosfato terminale dell’ATP a serine (Ser) o treonine (Thr) posizionate in specifiche sequenze amminoacidiche, perciò queste chinasi sono dette Ser/Thr chinasi; la fosforilazione può attivare o inibire la proteina substrato. Strutturalmente la PKA è formata da quattro subunità, due regolative e due catalitiche. Le subunità regolative normalmente agiscono da inibitori sulle due catalitiche, ma, quando legano il cAMP, cambiano conformazione e si staccano, consentendo alle catalitiche di fosforilare i relativi substrati. Poiché l’attività della PKA non può andare avanti indefinitamente, esistono due sistemi di controllo. Nel primo caso, la chinasi finisce per fosforilare anche il proprio recettore su uno specifico residuo di Ser, rendendo impossibile l’interazione con la proteina G. Nel secondo, il recettore viene fosforilato da altre chinasi in numerose Ser e Thr presenti nella coda citoplasmatica, alle quali si lega la proteina inibitoria β-arrestina, che blocca l’interazione con la proteina G accoppiata. In entrambi i casi delle Ser/Thr fosfatasi rimuovono i gruppi fosfato aggiunti dalla PKA ai substrati.
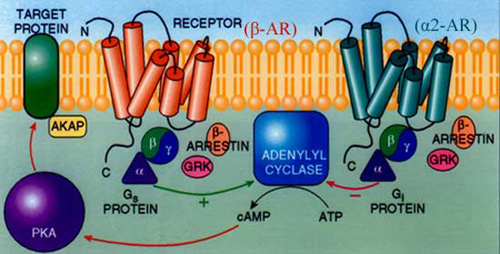
Da: http://www-insel.ucsd.edu/grafix/OstromSciMedFig1a.jpg
Si possono fare due importanti esempi di utilizzo di questa via di trasduzione. La PKA attivata dall’adrenalina nei muscoli scheletrici fosforila ed attiva la fosforilasi chinasi, la quale a sua volta fosforila ed attiva la glicogeno fosforilasi, che depolimerizza il glicogeno in glucosio per la glicolisi. Allo stesso modo, la PKA fosforila ed inibisce la glicogeno sintasi, che al contrario sintetizza glicogeno. Nelle cellule che producono somatostatina, invece, la PKA fosforila ed attiva una CREB protein (CAMP response element binding protein). Esso agisce da fattore trascrizionale in quanto si lega ad una specifica sequenza (CRE) nel promotore del gene della somatostatina, incrementandone la trascrizione.
Per quanto riguarda invece il Ca2+, esso é coinvolto principalmente in due vie di segnalazione: in cellule nervose, entra in cellula attraverso canali ionici dopo la depolarizzazione della membrana plasmatica inducendo la secrezione di neurotrasmettitori nelle sinapsi; oppure si ritrova in vie con recettori accoppiati a proteine G. Lo schema generale prevede che una proteina G trimerica, chiamata Gq, attivi l’enzima fosfolipasi C-β (PLC), che scinde un fosfolipide di membrana, il fosfatidilinositolo 4,5-bisfosfato (PIP2), in diacilglicerolo (DAG), che resta ancorato alla membrana, e inositolo 1,4,5-trisfosfato (IP3), libero al contrario di diffondersi in cellula.
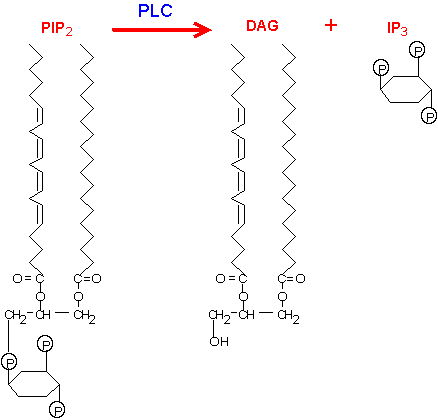
Da: http://www.web-books.com/mobio/free/images/Ch6D4.gif
L’IP3 lega i canali per il Ca2+ presenti sul reticolo endoplasmatico, che si aprono e rilasciano lo ione; il rilascio è un processo a feed-back positivo, cioè si auto-incrementa, e termina quando entrano in azione fosfatasi per l’IP3 o il calcio viene pompato fuori dalla cellula. L’aumento di concentrazione attiva la calmodulina (CaM), una proteina con alta affinità per questo ione, che lega le proteine bersaglio modificandone lo stato. La meglio conosciuta è la CaM chinasi II: il legame alla calmodulina la rende attiva, si autofosforila e si mantiene tale anche dopo che la calmodulina si stacca, almeno finchè non intervengono fosfatasi. La CaM chinasi è largamente presente nel sistema nervoso, dove fosforila e quindi attiva l’enzima l’enzima tirosina idrossilasi, che controlla la sintesi delle catecolamine, importanti ormoni. Il DAG, diversamente, co-attiva principalmente un’altra Ser/Thr chinasi, la proteina chinasi C (PKC), così chiamata perchè è dipendente dal Ca2+, altro co-attivatore. L’azione di questa chinasi in genere porta all’aumento della trascrizione di specifici geni, in quanto può inibire una proteina che sequestra un fattore trascrizionale (esempio: NF-кB), oppure può innescare una cascata di chinasi (MAP chinasi) che in ultimo fosforila e attiva sempre un fattore trascrizionale (Elk-1).
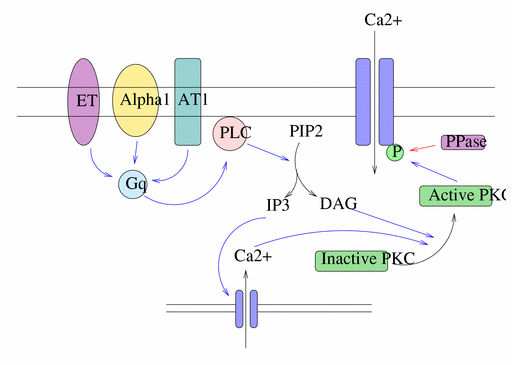
Ci sono numerosi esempi di utilizzo della via di traduzione degli inositolo fosfolipidi, tra cui l’acetilcolina nel pancreas e la vasopressina nel fegato.
Fonti: “Molecular biology of the cell”, Alberts, Bray,Lewis, Raff, Roberts, Watson, Garland Publishing