Feldspato potassico K [AlSi3O8] sigla Or (ortoclasio)
Feldspato sodico Na [AlSi3O8] sigla Ab (albite)
Feldspato calcico Ca [Al2Si2O8] sigla An (anortite)
Sono tettosilicati ossia strutture di tetraedri (Si,Al)O4 che si estendono indefinitamente in tre dimensioni; tra un tetraedro e l’altro ci sono in genere ampi spazi vuoti in cui vanno a situarsi cationi a grande raggio ionico tali da garantire l’elettroneutralità del composto. La massima simmetria compatibile con le impalcature che si formano è quella del gruppo spaziale C2/m monoclino, che è anche la simmetria di alcuni feldspati con distribuzione disordinata di Si ed Al nelle posizioni centrotetraedriche. Tuttavia la simmetria della maggior parte dei feldspati è inferiore a quella indicata sia perché la maggior parte delle strutture presentano una distribuzione ordinata di Si e Al al centro dei tetraedri e sia per lo schiacciamento delle cavità che ospitano cationi extratetraedrici più piccoli delle cavità stesse.
Se consideriamo ora i singoli termini puri e osserviamo le loro variazioni polimorfe in funzione di un diagramma P/T possiamo riscontrare che ogni termine presenta, a seconda delle condizioni di cristallizzazione, strutture diverse, a cui corrispondono minerali diversi.
Per il feldspato potassico K[AlSi3O8], si osserva (Fig. 1), che ad alta temperatura (~1050°C) esso cristallizza in un gruppo spaziale C2/m e viene chiamato sanidino. In questo minerale la distribuzione di Si e Al nelle posizioni centrotetraedriche è disordinata. Una distribuzione ordinata di Si e Al avviene a ~450°C e dà origine alla varietà microclino, che cristallizza nel sistema triclino C1. Tra i due estremi esiste una varietà solo parzialmente ordinata, monoclina, detta ortoclasio. E’ questo un caso di polimorfismo ordine-disordine, in cui alla stessa composizione chimica corrispondono più strutture cristallografiche, caratterizzate da un maggiore o minore ordinamento dei cationi Si e Al nelle posizioni centrotetraedriche Nel feldspati naturali, a seconda delle condizioni di formazione della roccia e della sua storia termica, si troverà l’una o l’altra fase. La distorsione della cella da monoclina a triclina avviene comunque con continuità e lentezza con gli angoli a e g che passano da 90° a valori di 91° e 88° rispettivamente. Senza cambiare forma esterna (in quanto il cristallo iniziale è monoclino) i cristalli devono cambiare il sistema di cristallizzazione e danno origine a due geminati con piani di contatto reciprocamente perpendicolari.
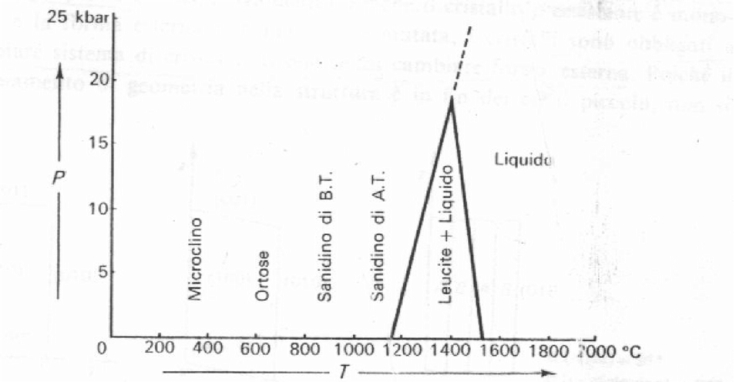 |
Fig. 1: Diagramma P/T del feldspato potassico.
 |
Fig. 2: Diagramma P/T del feldspato sodico.
Chiariremo in seguito le singole definizioni delle forme sopra specificate in funzione dei fenomeni di smescolamento.
La composizione dei diversi feldspati può essere derivata dall’analisi delle possibili combinazioni nei diversi sistemi: Or-Ab; Ab-An; Or-An; Or-Ab-An.
Sistema Or-Ab (Fig. 3)
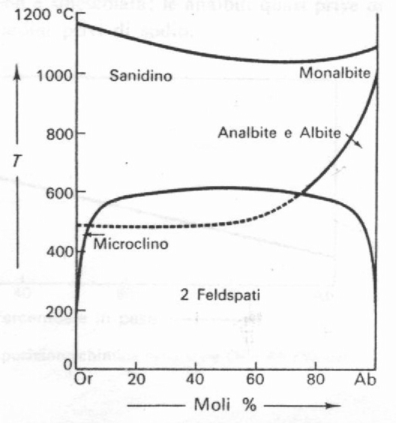
Il diagramma di cristallizzazione Or-Ab, sotto quattro diverse pressioni di H2O e a pressione normale (1 bar), mostra come all’aumentare della pressione del vapor d’acqua si ha un abbassamento della temperatura di fusione. Si tratta di diagrammi ottenuti da esperimenti di laboratorio in cui la curva di smescolamento si riferisce alle fasi disordinate cioè allo smescolamento tra sanidino e analbite (in laboratorio si ottengono normalmente solo le forme disordinate). La curva di smescolamento (curva a campana presente al di sotto dei 650°) varia comunque in maniera estremamente limitata al variare della pressione mentre quella del liquidus, come già detto, si abbassa vistosamente.
 |
Fig. 3: Diagramma di cristallizzazione Or-Ab sotto diverse pressioni.
|
Fig. 4: Probabile andamento della curva di smescolamento tra fasi ordinate.
• pertiti sensu stricto: abbondante matrice potassica in cui spiccano isole di feldspato sodico e formatesi per smescolamento di cristalli in genere potassici;
• mesopertiti: originatesi per smescolamento di cristalli composti e pressoché in egual misura dai due feldspati;
• antipertiti: abbondante matrice sodica in cui spiccano isole di feldspato potassico e formatesi per smescolamento di cristalli in genere sodici.;
Le due fasi che si originano per smescolamento in tutti i tipi di pertiti citati mantengono gli assi cristallografici con una orientazione ben determinata e vicina al monocristallo preesistente.
In conclusione: i prodotti finali ottenibili nel sistema Or-Ab sono molto diversi fra loro in funzione del decorso di raffreddamento.
In funzione di quanto detto riguardo i fenomeni di smescolamento possiamo ora anche meglio precisare che: il sanidino contiene percentuali variabili di molecole sodiche e in genere non presenta fenomeni di smescolamento; il microclino è frequentemente macropertitico con segregazione dell’eventuale feldspato sodico in isole sodiche distinte dal feldspato potassico triclinizzato; l’ortose contiene una percentuale ridotta di molecole sodiche, la fase solida mescolata può essere albite o analbite. L’analbite non è mescolata e possiede percentuali variabili di molecole potassiche.
L’albite, che in genere cristallizza priva di potassio, può presentare smescolamenti antipertitici e nel caso le isole potassiche sono spesso costituite da microclino
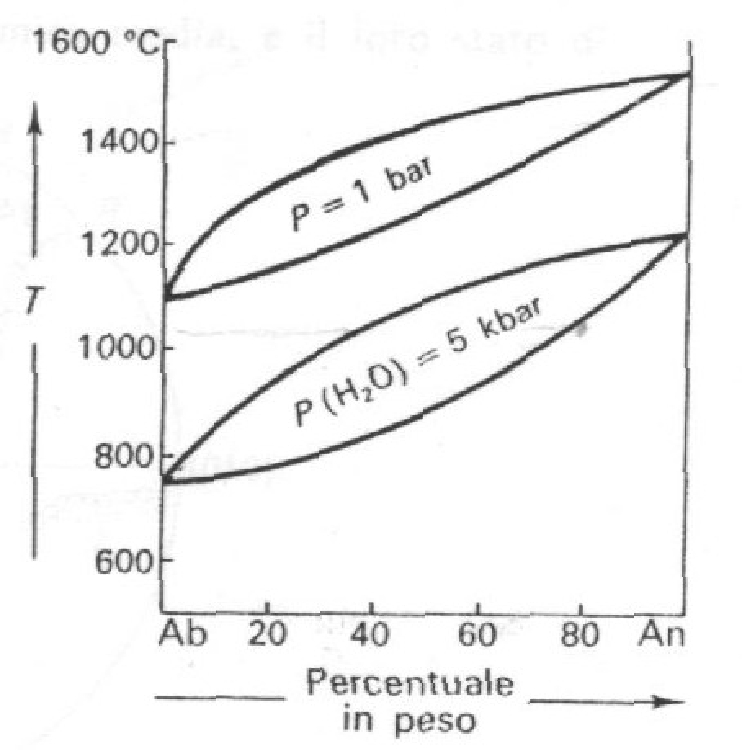
Sistema Ab-An
da Ab100An0 a Ab90An10 Albite
da Ab90An10 a Ab70An30 Oligoclasio
da Ab70An30 a Ab50An50 Andesina
da Ab50An50 a Ab30An70 Labradorite
da Ab30An70 a Ab10An90 Bytownite
da Ab10An90 a Ab0An100 Anortite
|
Fig. 5: Diagramma di cristallizzazione dei plagioclasi a diverse pressioni.
Sistema Or-An
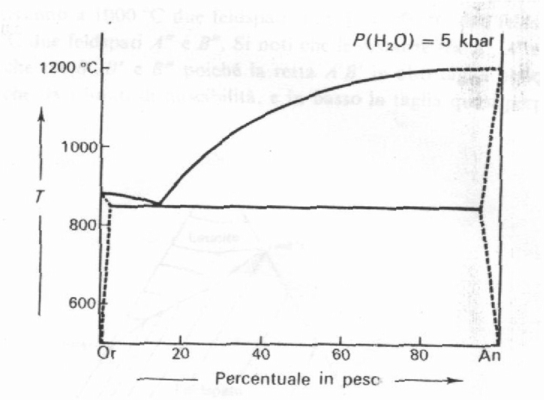
A basse pressioni compaiono in genere fasi di scarso interesse quali ad esempio leucite ed anortite esagonale). La miscibilità è scarsissima. Il diagramma (Fig.6) riporta solo l’isobara a P(H2O) = 5000 bar; sotto gli 850° non vi sono fasi liquide.
|
Fig. 6: Diagramma di cristallizzazione Or-An a pressione di H2O elevata.
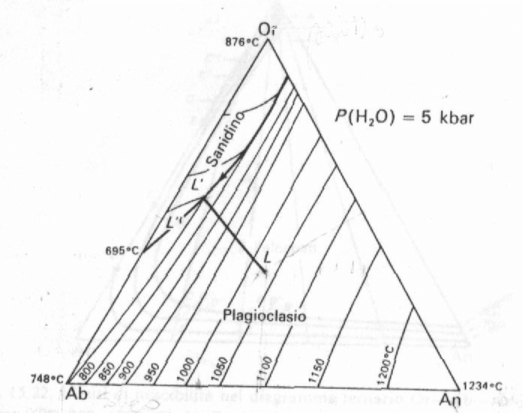
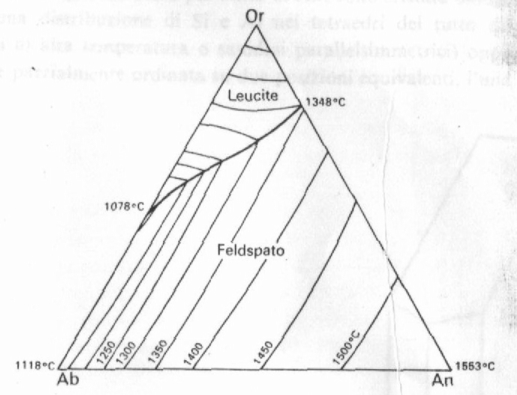
Tale sistema si rappresenta con un diagramma triangolare come riportato nella Fig. 7 e nella Fig 8, a diverse pressioni. La differenza tra i due diagrammi è tuttavia minima. Le temperature sono più alte a pressione ordinaria; dal lato del feldspato potassico cristallizza dapprima la leucite che poi reagisce con il liquido e passa a sanidino. Si noti che il triangolo è sempre diviso in due da una linea eutettoide lungo la quale cristallizzano due feldspati.
Per un approfondimento si consulti il libro “I minerali” di Glauco Gottardi Ed. Boringhieri.
|
Fig. 7: Diagramma ternario di cristallizzazione Or-Ab-An sotto pressione di H2O.
|
Fig. 8: Diagramma ternario di cristallizzazione Or-Ab-An a pressione ordinaria.
Nella fig. 9 si riportano i limiti di miscibilità ad alta temperatura (circa 1000 °C).

|
Fig. 9: limiti di miscibilità ad alta temperatura nel diagramma ternario Or-Ab-An.