La lista degli Amminoacidi componenti le proteine naturali è in effetti 20, oppure 21 se comprendiamo anche l’ornitina, che come dice la parola non si trobva nei mammiferi [dal greco antico: “ornis” = uccello). In questa trattazione tralasciamo la questione della chiralità degli amminoacidi.
Per completezza riporto di seguito l0elenco degli amminoacidi con la loro sigla:
| Nome* | Codice** |
Codice*** |
Descrizione *** | Molecola**** |
|
Alanine * |
Ala** | A*** | idrofobica*** | 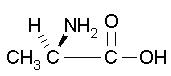 |
| Arginine C6H14N4O2 FW: 174.20 CAS:157-06-2 |
Arg | R | idrofila | 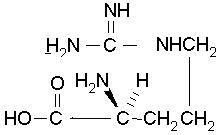 |
| Asparagine H2NCOCH2CH(NH2)CO2H FW: 132.12, CAS:2058-58-4 |
Asn | N | idrofila | 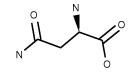 |
| Cysteine C3H7NO2S FW: 121.16 CAS:921-01-7 |
Cys | C | idrofila | 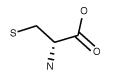 |
| Cystine C6H12N2O4S2 FW: 240.30 CAS: 56-89-3 |
2Cys | 2C | ———- | 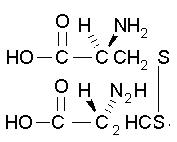 |
| Glutamine C5H10N2O3 FW: 146.14 CAS:5959-95-5 |
Gln | Q | moderata idrofila | 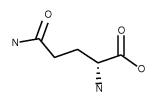 |
| Glycine C2H5NO2 FW: 75.07 CAS:56-40-6 |
Gly | G | anfotera | 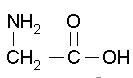 |
| Histidine C6H9N3O2 FW: 155.15 CAS:351-50-8 |
His | H | idrofila | 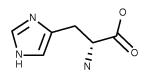 |
| Isoleucine C2H5CH(CH3)CH(NH2)CO2H FW:131.17 CAS: 319-78-8 |
Ile | I | idrofobica | 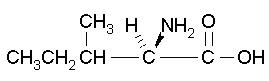 |
| Leucine (CH3)2CHCH2CH(NH2)CO2H FW: 131.17 CAS:328-38-1 |
Leu | L | idrofobica | 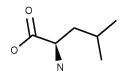 |
| Lysine C6H14N2O2 FW: 146.19 CAS: 923-27-3 |
Lys | L | idrofila | 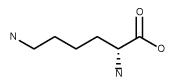 |
| Methionine C5H11NO2S FW:149.21 CAS: 348-67-4 |
Met | M | idrofobica | 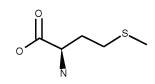 |
| Ornithine HCl C5H12N2O2 • HCl, FW:168.62 CAS:16682-12-5 |
Orn | O | idrofila | 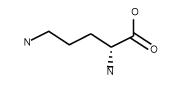 |
| Phenylalanine C9H11NO2 FW: 165.19 CAS: 673-06-3 |
Phe | F | idrofobica | 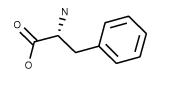 |
| Proline C5H9NO2 FW: 115.13 CAS: 344-25-2 |
Pro | P | idrofobica | 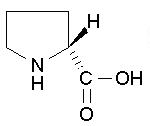 |
| Serine C3H7NO3 FW: 105.09 CAS: 312-84-5 |
Ser | S | idrofila | 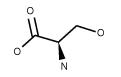 |
| Threonine CH3CH(OH)CH(NH2)CO2H FW: 119.12 CAS:72-19-5 |
Thr | T | idrofila | 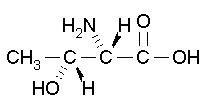 |
| Tryptophan C11H12N2O2 FW: 204.23 CAS:153-94-6 Trp |
Trp | W | idrofobica | 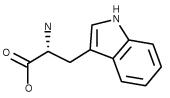 |
| Tyrosine 4-(HO)C6H4CH2CH(NH2)CO2H FW:181.19 CAS: 556-02-5 |
Tyr | Y | idrofobica | 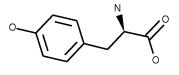 |
| Valine (CH3)2CHCH(NH2)CO2H FW: 117.15, CAS: 640-68-6 |
Val | V | idrofobica | 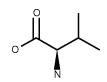 |
| FW = Formula weight | codice** | codice*** | Descrizione**** | Molecola ***** |
|
C.A.S = Chemical Abstract Service |
a 3 lettere | a 1 lettera |
Idrofilo= solubile in acqua Idrofobico= poco solubile in acqua |
Viene riportata Struttura molecolare |
Come si vede dalle strutture riportate ci sono molteplici possibilità strutturali e di ingombro strutturale e sterico.
Ma perchè gli amminoacidi in natura sono proprio 21 ed hanno queste forme?
La risposta non è assolutamente semplice, nè banale ed infatti fa parte di qui problemi parzialmente irrisolti della scienza.
E’ corretto infatti affermare che ci possano essere infinite possibilità, tuttavia a che prezzo?
Ricordiamo infatti che assemblare molecole costa energia (la moneta cellulare è l’ ATP, adenosin-trifostato) e l’energia non è gratuita nemmeno in natura. Per generare energia occorre consumare materie prime (alimenti) e per rifornirsi di materie prime occorre energia. Difatti gli organismi devono consumare più di quello che generano e ad ogni passaggio viene consumata una parte dell’energia disponibile.
Le cellule, che costituiscono le fabbriche delle molecole e delle proteine, per eseguire una reazione chimica necessitano di un enzima che la catalizzi e di altre molecole (vitamine, provitamine, sali, metalli, oligoelementi, altri reagenti) che controllino questa sintesi.
Lo scopo di assemblare gli amminoacidi sta nel produrre proteine necessarie al sostentamento dell’organismo stesso che le produce. Queste proteine hanno compiti: strutturali, regolatori, catalizzatori, immagazzinamento, replicazione, trasporto).
L’enzima è fatto anche esso di amminoacidi ed a volte di alcuni atomi metallici ed altre molecole inserite nella struttura (gruppo prostetico).
La sintesi di tutte le proteine è codificata nel DNA Nucleare della cellula; questo trasmette l’informazione ad un altro tipo di filamento nucleotidico, RNA (messaggero) che tramite l’aiuto di un altro tipo di RNA (ribosomiale) assembla gli amminoacidi in proteine.
In tutti questi passaggi appare una cosa lampante: gli amminoacidi vengono assemblati da altri gruppi di amminoacidi.
Quindi una possibile risposta al quesito del lettore è la seguente
durante il processo evolutivo che ha portato alla formazione di organismi a base di DNA, RNA e proteine, i fattori ambientali e competitivi hanno portato a selezionare una classe di molecole (gli ammoniacidi) che possedeva alcune caratteristiche particolari adatte ad usi molteplici ed una grande versatilità; queste caratteristiche possono essere riassunte in:
1) Hanno una base simile (HOOC-CR2-NH2): dal punto di vista energetico usare una sola base significa che con lo la stessa catena di reazioni (e di enzimi) risolvo il problema per molte molecole.
2) Cambiando anche di poco il gruppo funzionale (catena laterale) posso fare variare anche di molto le proprietà strutturali e funzionali della molecola
3) Hanno la importantissima possibilità di essere assemblate in catene polimeriche teoricamente lunghe a piacere. Con un solo amminoacidi posso produrre strutture rigide, flessibili, lunghe, corte, a seconda delle esigenze. Tutti gli amminoacidi hanno questa possibilità.
4) Possono inglobare altre molecole tramite reazioni con le catene laterali, ed in questo modo complessare metalli catalizzatori.
5) Le strutture polimeriche possono assumere strutture bidimensionali e tridimensionali tramite opportuni legami interni (cistina), ponti idrogeno, interconnesione (foglietti beta, alfa elica).
6) Queste macrostrutture possono avere funzione differente a seconda degli amminoacidi da cui sono costituiti. Variando anche di un solo amminoacido la sequenza polimerica è possibile produrre grandi variazioni (mutazione puntuale).
7) Sono chirali: questa è una questione controversa.
L’evoluzione (fattori di competizione e naturali) ha portato a selezionare da questa classe di composti solo alcune molecole: 21 amminoacidi. Con questo numero e questi tipi è possibile costruire tutti i tessuti funzionali agli organismi.