Nei mammiferi l’ossigeno è trasportato dalla emoglobina e conservato nei muscoli dalla mioglobina. L’emoglobina è una proteina formata da quattro catene o subunità, ognuna delle quali contiene un gruppo EME, in grado di legare l’ossigeno con un legame NON covalente. Ogni gruppo EME può legare una molecola di ossigeno e quindi in totale una molecola di emoglobina lega fino a quattro molecole di ossigeno. Il legame con la prima molecola di ossigeno rende più facile il formarsi del secondo legame EME-O2 che a sua volta rende più facile il terzo legame e così via. In effetti la emoglobina esiste solo in due stati o senza ossigeno o completamente satura, cioè con quattro molecole di O2 legate. L’ O2 non si distribuisce tra i gruppi EME delle molecole di emoglobina in modo casuale, ma una molecola di emoglobina già legata ha maggiore affinità e quindi è favorita nel processo di formazione del legame rispetto ad una molecola non legata. Consideriamo un insieme di molecole di emoglobina: in condizione di scarsità di O2 si hanno molecole completamente sature di O2 insieme a molecole senza ossigeno, invece di molecole tutte parzialmente saturate.
Questa è cooperazione cioè le variazione indotte alla molecola dalla formazione di un legame in uno dei siti aumentano la affinità negli altri siti di reazione.
La miogobina è presente in tutti gli animali superiori ed ha il compito di immagazzinare O2 a livello del muscolo. Questa proteina è formata da una sola catena, ha un solo gruppo EME quindi ha la possibilità di formare un solo legame. Una proteina dotata di un unico sito non può realizzare la cooperazione perché non risente dello stato di un’altra molecola.
Vediamo più da vicino la rappresentazione grafica del fenomeno.
Partiamo mettendo in ascisse i valori di pressione di Ossigeno contro la % di saturazione della mioglobina e della emoglobina. Per percentuale di saturazione si intende il rapporto tra quantità di proteina legata contro quantità di proteina totale.
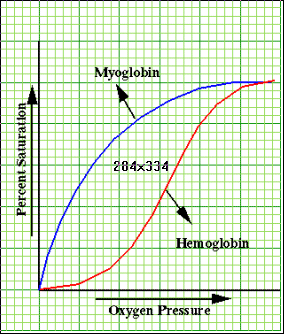
Questo grafico ha il seguente indirizzo.http://grserv.med.jhmi.edu/~raj/Research/Hemo/hemo.html .
La saturazione della mioglobina ha un andamento esponenziale, mentre la curva di saturazione della emoglobina ha un andamento sigmoide.
Passiamo al grafico di Hill
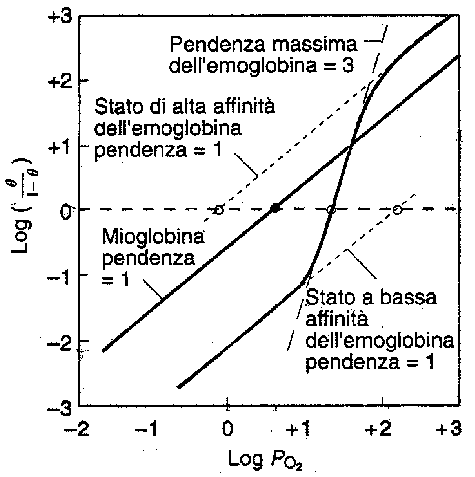

In questo grafico (da Biochimica di Mathews e van Holde – CEA) in ascissa è rappresentato il logaritmo della pressione parziale di O2 e in ordinata la funzione:
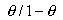
dove q è la pressione parziale di O2 e 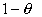 la pressione a cui metà delle molecole di mioglobina o emoglobina presenti sono saturate.
la pressione a cui metà delle molecole di mioglobina o emoglobina presenti sono saturate.
Come si vede la mioglobina non modifica la sua affinità per cui il numero di molecole legate dipende dall’aumento di O2, mentre la linea che rappresenta la affinità della emoglobina cambia pendenza in maniera netta nel senso di un deciso aumento.
La emoglobina è una proteina Allosterica cioè la formazione di un legame modifica la sua conformazione spaziale. Le proteine allosteriche possono avere due o più conformazioni ognuna delle quali ha proprietà differenti.
Immagini di struttura spaziale della emoglobina le trovi ai seguenti indirizzi
http://omlc.ogi.edu/spectra/hemoglobin/hemestruct/heme-l-ball.gif
http://www.chem.arizona.edu/courses/chem242/movies/heme.html