Etimologia
Cianuro
[cia-nù-ro] s.m. (chim) qualsiasi sale dell’acido cianidrico:
– di potassio , di sodio || Comp. di ciano- e -uro.
Ciano-
primo elemento di parole composte della terminologia scientifica e tecnica,
dal lat. cyanu(m), che dal gr. kyanos ‘azzurro’ e ‘minerale azzurro’
(cianina); in chimica indica la presenza del gruppo ciano, o gruppo
nitrilico (cianico, cianogeno).
Stato di
ossidazione
Lo stato di ossidazione
di un atomo in una molecola si calcola osservando i legami che forma con
le specie atomiche circostanti, considerando che legami fatti con specie
più elettronegative contribuiscono con +1 per ciascun legame, mentre legami
fatti con specie meno elettronegative contribuiscono con -1 per ciascun
legame. Nel nostro caso l’atomo più elettronegativo sarà l’azoto N, mentre
quello meno elettronegativo sarà il carbonio C.
Per calcolare
lo stato di ossidazione formale con il metodo suddetto è preferibile
partire dall’acido H-CN dove i numeri di ossidazione sono gli stessi (vale
la regola che la specie più elettronegativa sarà carica
– rispetto a quella meno elettronegativa +):
legame H-C, H(+1)
C(-1)
legame C-N, C(+1)
N(-1), essendoci tre legami diviene: C(+3), N(-3)
totale: C(-1+3=+2),
N(-3), carica netta sulla molecola (-1) CN–
Riassumendo,
lo stato di ossidazione è: H(+1), C(+2), N(-3)
Carica formale
La carica formale delle specie atomiche implicate nel legame si calcola
invece considerando il numero di elettroni presenti nell’intorno molecolare
rispetto a quelli di partenza che possiede l’atomo neutro:
-
il carbonio
C parte con 4 elettroni nello strato più esterno (IV gruppo)
e si ritrova con 5 elettroni finali (infatti CN– si può
scrivere :CºN: )
2 liberi e 3 impegnati nel triplo legame con l’azoto, per cui
la carica formale è -1 -
l’azoto
N parte con 5 elettroni nello strato più esterno (V gruppo)
e si ritrova con 5 elettroni finali (2 liberi e 3 impegnati nel triplo
legame col C), per cui la carica formale è 0 (zero).
Quindi formalmente la carica
negativa (-) è sul C.
Dalla teoria dell’orbitale molecolare con il diagramma
di distribuzione del livello delle energie di legame possiamo ottenere
informazioni circa la carica reale presente sulle specie della molecola.
Considerando
il diagramma delle energie secondo il modello MO l’elettrone in più
va a posizionarsi sul primo orbitale libero a più bassa energia
disponibile, sx come indicato
dalla figura seguente per il fatto che tale distribuzione minimizza l’energia:
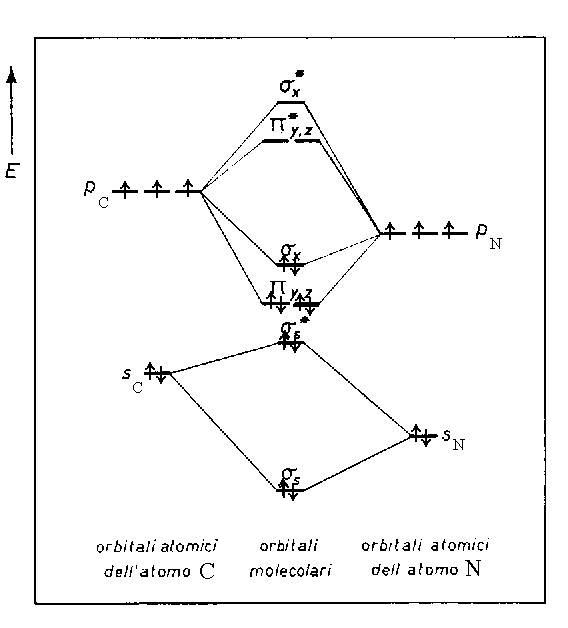
La configurazione
elettronica delle molecole con dieci elettroni di valenza secondo la teoria
dell’orbitale molecolare è nello stato fondamentale: [KK s2s
s*2s p4y,z
s2x], con
un ordine di legame 3 (1s, 2p) e la
distanza inter-atomica tra C ed N in CN– è dCN
= 114 pm.
Dato che l’orbitale di legame
s2x è più
vicino al livello energetico degli orbitali dell’azoto, sarà l’azoto
a sentire maggiormente la presenza dell’elettrone in più per cui
il legame sarà polarizzato verso l’azoto che avrà carica
reale d -, mentre il carbonio sarà
d – (la misura effettiva della carica
in Coulomb viene determinata sperimentalmente tramite diffrazione elettronica
e neutronica).
Proprietà,
sali comuni, complessi e caratteristiche
I cianuri dei metalli alcalini
ed alcalino terrosi sono solubili in acqua e danno soluzioni alcaline
(basiche)per idrolisi, poiché l’acido cianidrico è un acido
debole (Ka = 4,8×10-10 a 298K) , mentre la maggior parte dei
cianuri dei metalli di transizione sono poco solubili [ AgCN, Hg2(CN)2,
Pb(CN)2 ] come gli ioduri corrispondenti.
Dato che ad alte concentrazioni
di ioni CN- si formano complessi, questo ione è utilizzato in metallurgia
per separare e solubilizzare come complessi metallici i metalli anche
della serie di transizione (Au, Ag, Cu).
Un complesso molto noto ai chimici
è l’esa-ciano-ferrato (II) di potassio (K2[Fe(CN)6],
utilizzato moltissimo negli inchiostri e nei coloranti azzurro – blu (blu
di Prussia). Altri esempi di sali complessi sono: K4[Ni(CN)4],
tetracianonichelato (0) di potassio; K3[Fe(CN)6]
esacianoferrato (III) di potassio; Na4[Mo(CN)8],
ottacianomolibdato (IV) di sodio.
Sintesi cianuro
di sodio
Il cianuro di sodio si prepara
industrialmente facendo reagire ad alta temperatura la calciocianammide
CaNCN con carbone e carbonato sodico:
CaNCN + C+ Na2CO3
![]()
CaCO3 + 2NaCN
La calciocianammide si forma
riscaldando a ~1000°C il carburo di calcio, CaC2, con azoto:
CaC2 +N2
![]()
CaNCN + C
Isolettronicità
Lo ione cianuro CN–
è isoelettronico con la molecola N2, con quella di CO,
e con lo ione NO+. Pertanto può formare complessi con
le stesse specie atomiche metalliche, complesi che dovranno avere contro
ioni per bilanciare le cariche:
Ni(CO)4, nichel tetracarbonile
Ni(CN)6]4-,
nichel tetracianuro (con K4 come contro ione)
Bibliografia
-
Introduzione alla chimica
moderna, M. Nardelli, Ambrosiana (MI), 2a ed. 1991 -
La nuova enciclopedia delle
scienze garzanti, 1a edizione, 1988 -
Il grande dizionario garzanti
della lingua italiana, 2a edizione 1988