Il calcare (carbonato di calcio: CaCO3) è un composto molto comune sulla crosta terrestre; è poco solubile in acqua e quel poco che si scioglie si trova nell’acqua sotto forma di ione calcio (Ca ++ ) e di ione carbonato (CO3– –); la dissoluzione di un sale così poco solubile è un processo di equilibrio che può essere così sintetizzato:
CaCO3 (s) 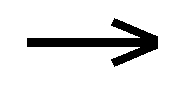 Ca ++ (aq) + CO3 – – (aq)
Ca ++ (aq) + CO3 – – (aq)
Il simbolo (s) indica lo stato solido del calcare e l’indicazione (aq) suggerisce che i due ioni sono solubilizzati in acqua.
L’anidride carbonica (CO2) è un gas presente nell’aria atmosferica e manifesta nei confronti dell’acqua una notevole affinità; quando l’anidride carbonica viene a contatto con l’acqua (H2O), prima si solubilizza (si “scioglie”) in essa e quindi si converte in acido carbonico (H2CO3):
CO2+ H2O
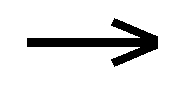 H2CO3
H2CO3
Una volta formatosi, l’acido carbonico si frammenta, parzialmente, in ione bicarbonato (HCO3–) e ione idrogeno (H +):
H2CO3
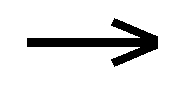 HCO3– + H+
HCO3– + H+
Queste due ultime reazioni hanno luogo, in identica sequenza, ogni qualvolta l’acqua viene addizionata di anidride carbonica (acqua frizzante); è proprio la modesta quantità di ioni idrogeno così formati che dà al nostro palato la sensazione frizzante delle bevande gassate.
L’acqua piovana, dopo aver solubilizzato l’anidride carbonica incontrata lungo il percorso di caduta, si arricchisce in ioni idrogeno, cioè diventa acida. La debole acidità delle acque naturali costituisce un fattore cruciale nella dinamica delle rocce calcaree, rendendo possibile una serie di fenomeni usualmente riassunti nel termine carsismo.
Quando l’acqua piovana viene a contatto con il calcare, prima lo solubilizza (lo “scioglie” in sé) e quindi converte lo ione carbonato (CO3– – ) in ione bicarbonato (HCO3–) :
CO3– – + H+
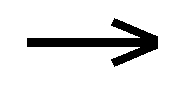 HCO3–
HCO3–
Questa semplice trasformazione altera l’equilibrio prima ricordato:
CaCO3 (s)
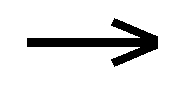 Ca++ (aq) + CO3– – (aq)
Ca++ (aq) + CO3– – (aq) favorendo la solubilizzazione di ulteriore calcare. È questo il modo con cui l’acqua piovana scava lentamente ma inesorabilmente le cavità carsiche.
Possiamo riunire le quattro reazioni esposte in una unica trasformazione un po’ più complessa, ampiamente citata nei testi che trattano il fenomeno del carsismo:

Una bella immagine del “cielo” di una grotta carsica con numerose stalattiti.
CaCO3 (s) + CO2 (g) + H2O (l) 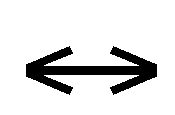 Ca ++ (aq) + 2 HCO3– (aq)
Ca ++ (aq) + 2 HCO3– (aq)
La indicazione (g) indica lo stato gassoso e la indicazione (l) lo stato liquido; la doppia freccia indica una condizione di equilibrio tra le sostanze disposte a destra e quelle disposte a sinistra.
Se questa acqua che si è arricchita in ione calcio (detta usualmente acqua “dura”) giunge in un ambiente povero in CO2 (come si verifica nel sottosuolo), l’equilibrio viene alterato e deve cercarsi una nuova posizione. In questo caso specifico l’equilibrio si sposta verso sinistra (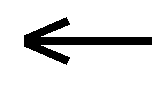 ), con conseguente formazione di CaCO3–. In definitiva una diminuzione dell’anidride carbonica provoca la deposizione di calcare solido.
), con conseguente formazione di CaCO3–. In definitiva una diminuzione dell’anidride carbonica provoca la deposizione di calcare solido.
Così si formano stalattiti e stalagmiti nelle cavità carsiche.

Una grotta carsica con stalattiti (in alto) e stalagmiti (in basso).
Dopo aver esaminato le basi chimiche che spiegano la mobilità del calcare, cerchiamo una risposta al quesito proposto, senza perdere di vista l’equazione complessiva che riassume la chimica del calcare.
CaCO3 (s) + CO2 (g) + H2O (l)  Ca ++ (aq) + 2 HCO3– (aq)
Ca ++ (aq) + 2 HCO3– (aq)
Parte dello ione calcio (responsabile della durezza dell’acqua) si toglie per diventare calcare insolubile.
Per concludere: La solubilizzazione del calcare altro non è che lo “scioglimento” del carbonato di calcio nell’acqua (piovana o meno) con caratteristica di acidità.