La percezione di un profumo avviene grazie alla reazione chimica delle molecole con il nostro apparato olfattivo. Questo generalmente viene innescato quando solo poche molecole (in senso termodinamico: si parla sempre di alcuni miliardi…) raggiungono le mucose nasali e possono reagire chimicamente con i nostri recettori. Per capire la velocità con la quale si percepiscono gli odori occorre fare riferimento ai meccanismi di trasporto di un gas dentro un altro. Questo può avvenire con meccanismi diversi: diffusione molecolare e trasporto turbolento. La diffusione molecolare si può comprendere pensando ai gas come insiemi di palline in perenne agitazione, ed al conseguente mescolamento di due tipi di biglie differenti. Questo è un meccanismo molto lento ma alla lunga molto efficace (in atmosfera ha permesso il mescolamento dei clorofluorocarburi fino all’alta stratosfera!), mentre i fenomeni di diffusione turbolenti possono aumentare di vari ordini di grandezza la velocità del trasporto molecolare. Tuttavia, come vedremo nel seguito, a brevi distanze la velocità di diffusione è elevata. Se poi l’aria di una stanza non è immobile (persone o sportelli che si muovono, porte o finestre aperte) si innescano fenomeni di trasporto immensamente più efficaci della diffusione molecolare, capaci di propagare le poche molecole necessarie all’attivazione dello stimolo in pochi secondi. Probabilmente, il solo gesto di stappare una bottiglia produce abbastanza turbolenza per diffondere molto velocemente gli odori.
Infine, una nota riguardo al fatto che la velocità massima di trasporto di materia che ci possiamo aspettare in aria è all’incirca la velocità del suono. Infatti, la propagazione del suono è consentita dagli urti delle molecole d’aria con le loro vicine. Tali urti si susseguono alla velocità con la quale le molecole stanno mediamente viaggiando nel gas! Infatti tale quantità (vs=√ (1.4RT/M)) è molto vicina alla velocità quadratica media prevista dalla distribuzione di Maxwell-Boltzmann (
Qui di seguito vengono approfonditi la diffusione molecolare ed il trasporto turbolento in relazione alla percezione degli odori.
La diffusione molecolare
Pensando alla struttura atomica o molecolare dei gas, ci si rende facilmente conto che il cammino di una molecola lasciata libera di muoversi nello spazio ‘occupato’ da un altro gas in equilibrio è ostacolato da una serie di urti con le molecole o gli atomi di questo. Il percorso effettuato consisterà allora in una traiettoria molto contorta e avvoltolata su se stessa. Potendo vedere al microscopio il moto si osserva una serie di continui piccoli spostamenti, apparentemente casuali, del corpo sotto osservazione.
Abbiamo così introdotto due concetti fondamentali della diffusione e dei sistemi complessi in generale: il ‘random walk’ (o passeggiata casuale) e il moto browniano. La prima osservazione del moto browniano viene fatta risalire a Robert Brown che la descrisse nel 1828 guardando il moto dei grani di un polline in acqua, ma solo il contributo fondamentale di Einstein, nel suo annus mirabilis 1905, permise di dare una descrizione quantitativa degli effetti del moto browniano. Per approfondire si può consultare il sito dell’enciclopedia Treccani: http://www.treccani.it/scuola/lezioni/fisica/motobrowniano.html.
Partendo dalla teoria cinetica dei gas, sappiamo che la temperatura è una misura dell’energia cinetica media delle molecole (o atomi) che lo costituiscono. Fissate le caratteristiche del gas, le velocità molecolari sono descritte dalla statistica di Maxwell-Boltzmann.
L’animazione contenuta alla pagina: http://it.wikipedia.org/wiki/Teoria_cinetica_dei_gas dà un’idea di come sarebbe la visione di una piccola porzione di gas se le molecole ( o atomi) potessero essere osservate direttamente. In questa pagina, invece, si può vedere l’animazione di un certo numero di particelle in moto browniano.
La diffusione nasce dunque da questa dinamica ‘caotica’ dei costituenti del gas. La teoria cinetica dei gas, sviluppata a fine Ottocento, permette di connettere le grandezze microscopiche (numero di molecole, velocità, massa, cammino libero medio) alle grandezze termodinamiche (pressione, temperatura, volume). Ci aspettiamo quindi di poter descrivere in maniera quantitativa i processi di diffusione a partire dalle grandezze microscopiche e correlarle alle grandezze macroscopiche: su un grande numero di particelle in moto browniano si possono desumere delle caratteristiche medie ricavabili in maniera classica. Si può infatti dimostrare che lo scostamento quadratico medio di una particella sottoposta a moto browniano è proporzionale alla radice quadrata del tempo, risultato che ricaveremo tra poco utilizzando un approccio classico.
L’approccio macroscopico (termodinamico), infatti, si avvale delle equazioni della diffusione – introdotte da Fourier per descrivere la diffusione del calore ad inizio Ottocento e dal fisiologo Adolf Fick che le applicò alla diffusione di materia nel 1855. Procedendo verso l’approccio microscopico, tali equazioni si sono via via evolute nella teoria di Einstein e Smoluchowsky, nelle equazioni di Langevin e di Fokker-Plank. Queste ultime equazioni sono dette stocastiche, in quanto una o più funzioni coinvolte rappresentano un processo casuale: in pratica si studia come evolve la distribuzione di probabilità di una data variabile. Rimanendo con i piedi per terra, possiamo partire dalle leggi di Fick (http://www.treccani.it/enciclopedia/legge-di-fick_%28Enciclopedia_della_Scienza_e_della_Tecnica%29/), che descrivono la diffusione di una sostanza in un mezzo. Se il mezzo è omogeneo e isotropo l’equazione della diffusione diventa:
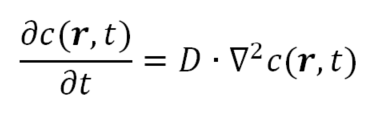
Ove c è il campo di concentrazione (che dipende dal punto e dal tempo) e D è la diffusività, un parametro (macroscopico) che dipende dalla capacità di una molecola di diffondere all’interno di un mezzo. Appare quindi ragionevole che il parametro D dipenda sia dalla specie diffondente che dal mezzo in cui diffonde (oltre che da pressione e temperatura!). Considerando ammoniaca in aria, ad esempio, a temperatura ambiente e pressione atmosferica, D si può assumere pari a 0.783 cm2/s.
Supponendo di immettere in un punto una certa quantità di materia (possiamo immaginare a questo punto sia una concentrazione di massa che un certo numero di molecole), si può allora ricavare la distribuzione della concentrazione ad un tempo t arbitrario (o, alternativamente, la distribuzione di probabilità delle posizioni delle molecole, il che sui grandi numeri coincide con la concentrazione!).
La soluzione dell’equazione della diffusione, sotto ipotesi ragionevoli per la nostra schematizzazione, è data dalla funzione:
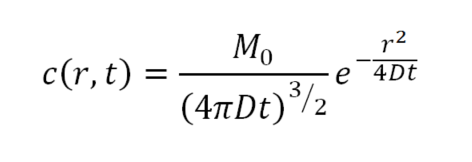
ove r indica il modulo di r, e che rappresenta una gaussiana che si allarga con varianza 2Dt. Per conservare la massa totale occorre che il massimo decresca coerentemente, descrivendo la diminuzione della concentrazione del diffondente nel punto di immissione.
Nella figura seguente sono illustrati i profili di concentrazione a tempi diversi, per mezzo grammo di ammoniaca immessa nell’origine al tempo 0.
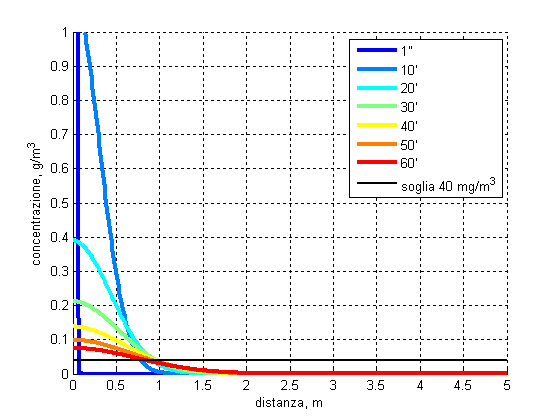
A questo punto però si può notare che, teoricamente, anche a distanze molto grandi la probabilità è non nulla a tempi anche prossimi allo zero. Ciò è chiaramente assurdo in quanto contrasta con i postulati della relatività ristretta, ma questo è facilmente giustificabile in quanto questo risultato è stato interamente ricavato nell’ambito della meccanica classica. Tuttavia, nel random walk può accadere (e su tante molecole accade), che le più ‘fortunate’ imbrocchino la sequenza giusta di urti che le trasporta velocemente a grande distanza. La distribuzione della concentrazione vale quindi sui grandi numeri, ma a grandi distanze e piccoli tempi occorre tenere conto della natura discreta dei gas e che quindi le fluttuazioni possono essere significative.
Trasporto turbolento
La trattazione del trasporto turbolento è molto più complessa di quella della diffusione. Il moto di fluidi sottoposti a forze di pressione e attrito è descritto infatti dalle equazioni di Navier-Stokes, equazioni differenziali alle derivate parziali non lineari, che per alcuni valori dei parametri non ammette soluzione analitica (la sua risoluzione analitica generale è considerata uno dei 7 problemi aperti della matematica per il nuovo millennio). Per di più, si dimostra che per quanto si scelgano vicine le condizioni iniziali di una particella di fluido, le soluzioni nei due casi differiranno di una quantità finita. Questa è la base del cosiddetto comportamento caotico dei sistemi dinamici, e fa capire che in tali condizioni due particelle di fluido vicine all’inizio possono ritrovarsi molto distanti dopo poco tempo. Le equazioni di Naver-Stokes possono ovviamente anche descrivere un moto non turbolento, nel quale il meccanismo di diffusione è ancora dominato dalla diffusione molecolare. Tutto dipende dal rapporto tra le forze inerziali e le forze viscose che agiscono sul fluido (numero di Reynolds). A seconda del fluido e delle dimensioni tipiche del fenomeno si può facilmente avere trasporto turbolento in una stanza e pertanto rapida diffusione degli odori.
Percezione degli odori
Su questo discorso si innestano i meccanismi fisiologici della stimolazione sensoriale. Questa, in generale, richiede un valore minimo per la attivazione, e secondo la legge di Weber-Fechner mostra un andamento stimolo-sensazione di tipo logaritmico, per cui una volta giunte al naso un certo numero di molecole (soglia di percezione) lo stimolo è attivato e l’odore viene percepito con una intensità che è notevolmente distorta rispetto alla concentrazione reale. Va osservato poi che ogni molecola ha una propria capacità di stimolazione: a parità di concentrazione, alcune sostanze saranno avvertibili mentre altre no!
Possiamo allora cercare di costruire un semplice modellino che a partire dalla soluzione dell’equazione del trasporto ci dica se e dopo quanto tempo la sostanza può essere annusata ad una certa distanza dall’immissione (nel caso di pura diffusione molecolare!).
Per 1.5 mg di ammoniaca rilasciata nell’origine al tempo 0 si nota che la concentrazione evolve con profilo gaussiano che si allarga e si abbassa nel tempo. Questo descrive il fatto che i cammini casuali delle molecole diffondenti si allontanano gradualmente dall’origine, ma non in maniera lineare, in quanto tanto più sono lontani, tanto più è facile per loro tornare verso zone già raggiunte piuttosto che colonizzare zone nuove!
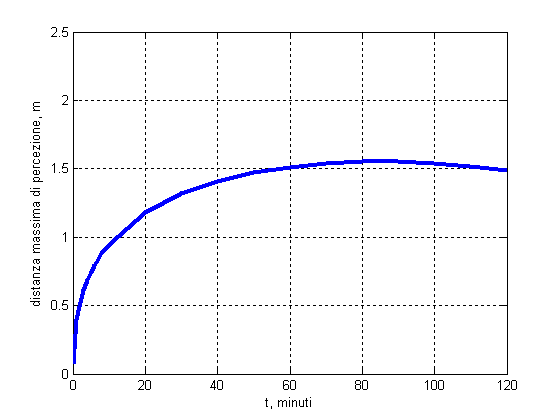
Ci si può allora chiedere come cambi la distanza alla quale la soglia di rilevabilità olfattiva dell’ammoniaca, circa 0.03 mg/m3, (in figura 1 è indicata una soglia maggiore, di 40 mg/m3 indicata come avvertibile da tutti) è raggiunta al variare del tempo. Le soglie sono prese da: R. G. Rice, A. Netzer: Handbook of ozone technology and application, Vol.1, Ann Arbor Science, The Butterworth Group, 1982.
Si può calcolare quindi l’andamento delle intersezioni delle curve di concentrazione con la soglia di rilevabilità (linea nera) per ogni tempo.
Il risultato è mostrato nella figura seguente, e si notano vari aspetti interessanti.
1. Infatti, notiamo che l’andamento non è lineare né monotono, per i motivi che abbiamo discusso: all’inizio le molecole, camminando casualmente, possono solo allontanarsi dall’origine. In seguito, allontanandosi, hanno a disposizione molto più spazio in cui diluirsi e pertanto il ritmo di espansione della bolla ‘annusabile’ diminuisce.
2. Inoltre, tende a contrarsi quando la diluizione diventa talmente alta da rendere irrilevabili le zone più periferiche e quindi più diluite. Per questo motivo (a parte reazioni chimiche che possono modificare la sostanza diffondente) dopo un certo tempo l’odore non è più avvertibile (NB: sempre in ambiente molto grande rispetto alla distanza tra punto di emissione e punto di rilevazione). Nel caso di una stanza chiusa, infatti, il modello deve tenere conto del volume limitato e quindi del fatto che le molecole 'rimbalzano' sulle pareti e tornano indietro. Si possono mettere opportuni vincoli all'equazione descritta sopra, ma in tal caso la soluzione si complica non poco dal punto di vista del calcolo. Quindi avere una descrizione quantitativa dei tempi di diffusione in un ambiente chiuso si rivela piuttosto complicato. Comunque possiamo in ogni caso tentare una grezza stima 'all'equilibrio' di quanta sostanza serve per poter essere avvertita all'interno di una stanza. Tornando all'esempio dell'ammoniaca, in una stanza di 50 m3 (circa 4x4x3 m), sono necessari 50×0.03=1.3 mg. Tenendo conto che l'ammoniaca venduta al supermercato è in realtà ammoniaca in soluzione acquosa al 30%, possiamo stimare che l'odore si avverte quando 0.043 ml di soluzione evaporano completamente in aria (cioè una sola goccia!). Per avere invece la 'odorabilità' da parte di tutti, occorre utilizzare la soglia più alta che abbiamo indicato in fig. 1, cioè 40 mg/m3. In tal caso la quantità di soluzione necessaria è 66 ml (quattro cucchiai…)!
Sarebbe interessante condurre un esperimento di questo tipo, ma le condizioni devono essere ben controllate per evitare di sovrapporre il trasporto turbolento alla diffusione molecolare!
Ci si può stupire del fatto che in un’ora l'ammoniaca sia rilevabile solo a meno di due metri di distanza. Questo fa capire quanto sia lento il processo di diffusione molecolare, e perché nelle notti invernali (quando l’aria è molto stabile non essendoci turbolenza indotta dal riscaldamento solare) le concentrazioni di inquinanti siano in genere molto alte, mentre invece in soleggiate giornate estive e primaverili i valori misurati siano molto inferiori. Si stima infatti che il tempo tipico di mescolamento durante i regimi fortemente convettivi dello strato limite planetario (1-2 km di spessore) sia di appena 15 minuti.
Ringrazio Nicola Buratti per l'aiuto sulle soglie di rilevabilità e sui conti della diluizione. Mi ha inoltre suggerito il seguente link ove è possibile trovare maggiori dettagli sulla percezione degli odori: