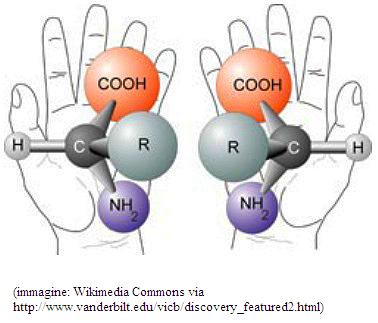
Chirale è definita una molecola che non è sovrapponibile alla propria immagine speculare, come la mano sinistra nei confronti della destra (e dalla parola greca "mano" deriva proprio il termine "chirale"). La causa più diffusa di chiralità in natura è la presenza di uno o più atomi di carbonio asimmetrici, ovvero atomi di carbonio legati a quattro gruppi (atomi o molecole) diversi. Due molecole reciprocamente chirali costituiscono una coppia di "stereoisomeri", composti aventi gli stessi atomi ma disposti in modo diverso nello spazio. In particolare si tratta di enantiomeri. Due enantiomeri hanno un diverso potere rotatorio ottico, ovvero ruotano dello stesso grado ma in direzioni opposte (sinistra o levogira, destra o destrogira), il piano della luce polarizzata, quella luce che esce da un filtro in grado di far passare le onde elettromagnetiche solo in uno dei diversi piani lungo cui oscillano nello spazio. Uno dei sistemi di classificazione divide gli enantiomeri in L ("sinistrorsi") e D ("destrorsi"), dove queste lettere indicano che la molecola presenta una stereochimica correlata, per convenzione, a quella dell’enantiomero levogiro o destrogiro, rispettivamente, della gliceraldeide. Va sottolineato che la classificazione L e D non dà informazioni sul potere rotatorio della luce, ma si riferisce solo ad una conformazione chimica di riferimento, quella della gliceraldeide appunto, la cui forma L è anche casualmente levogira. L non significa però necessariamente levogiro, né D destrogiro.
La chiralità è una proprietà diffusa fra le molecole biologiche. Essa è implicata in diversi processi, dalla determinazione della conformazione delle proteine alla loro sintesi, dalla replicazione del DNA, al riconoscimento di un substrato da parte del suo enzima o nel legame di una molecola al suo recettore. Nel mondo vivente due importanti classi di molecole sono chirali: la maggior parte degli zuccheri sono nella forma D, mentre gli amminoacidi, i componenti delle proteine, sono nella forma L, escluso l’amminoacido glicina, che non è una molecola chirale. Queste due classi di biomolecole sono quindi omochirali, ovvero tutti i loro componenti sono, con poche eccezioni, nella stessa forma enantiomerica.
L’origine dell’omochiralità degli amminoacidi (e degli zuccheri) è stata a lungo un mistero e non c’è ancora una spiegazione del tutto esauriente. Tuttavia sono stati ipotizzati diversi meccanismi che, insieme ai risultati di alcuni esperimenti, forniscono un quadro di insieme abbastanza indicativo di come devono essersi svolti i fatti nel mondo prebiotico. Il problema è comprendere come, inizialmente, si sia creato un eccesso di un enantiomero rispetto ad un altro e come questo eccesso sia stato poi amplificato fino a diventare una caratteristica permanente di queste molecole biologiche.
Gli amminoacidi dovevano essere presenti inizialmente in entrambe le forme L e D, in un rapporto sostanzialmente pari a uno (quello che si definisce un racemo). Si devono quindi essere create delle fluttuazioni locali della concentrazione relativa delle due forme. Queste possono essere state casuali ma alcuni fattori le hanno senz’altro favorite. Le superfici di minerali come quarzo, caolinite o carbonato di calcio, i cui cristalli sono spesso a loro volta dotati di strutture asimmetriche, si dimostrano in grado di assorbire preferenzialmente la forma L o D di amminoacidi come alanina e acido aspartico. Questa proprietà può avere favorito la formazione di polimeri di amminoacidi omochirali, a livello della superficie delle comuni rocce e sedimenti nell’acqua.
L’arricchimento di un isomero rispetto all’altro è stato sperimentalmente ottenuto studiando il comportamento degli amminoacidi all’equilibrio fra fase solida-cristallina e liquida, a particolari condizioni chimico-fisiche. Quando gli amminoacidi sono disciolti in soluzione acquosa, le due forme L e D si separano parzialmente nel momento in cui passano allo stato solido, ovvero quando, durante l’evaporazione dell’acqua, gli amminoacidi si concentrano fino a formare strutture solide cristalline. Questo è stato osservato, per esempio, nel caso dell’acido aspartico. Il grado di purezza di questi cristalli è variabile, ma differenze, inizialmente anche piccole, della concentrazione di L o D, possono essere amplificate attraverso ripetuti equilibri di dissoluzione-cristallizzazione. Anche in questo caso, sedimenti e materiale minerale possono aver svolto da catalizzatori di questo processo. L’aumento relativo di un enantiomero può essere stato indotto anche da agenti fisici come determinate radiazioni cosmiche. Lunghezze d’onda nell’ultravioletto, nella loro componente cosiddetta “circolarmente polarizzata”, tendono a distruggere selettivamente uno solo dei due enantiomeri. Questo avviene perché tali radiazioni, essendo polarizzate, cioè anch’esse “asimmetriche” nello spazio, alterano preferenzialmente la struttura molecolare di una sola delle due forme. Ciò è rilevante se si accetta l’ipotesi che almeno alcune delle molecole organiche necessarie alla vita siano giunte sulla Terra “seminate” da oggetti in transito come comete o trasportate direttamente sul pianeta dalla caduta di meteoriti. La celebre meteorite di Murchison, caduta nel 1969 in Australia, contiene infatti molte molecole bio-organiche, fra queste proprio amminoacidi, ed è stato osservato che di alcuni di questi c’è un leggero sbilanciamento a favore della forma L. La parziale distruzione della forma D può essere causata proprio dalle radiazioni “circolarmente polarizzate”. Ma queste radiazioni possono aver influito anche sulla superficie terrestre, agendo come un fattore selezionatore a livello globale, non solo locale.
Se si rimane nella “ipotesi oggetti celesti”, c’è anche un altro fenomeno che può spiegare perché una delle due forme possa aver prevalso. Prima dell’impatto sulla Terra, un meteorite subisce un enorme riscaldamento a causa dell’attrito con l’atmosfera. In questa fase parte delle sostanze presenti sulla sua superficie sublimano, ovvero si vaporizzano dallo stato solido in cui si trovavano. Questo consente loro di “fluttuare” nell’aria e precipitare, sopravvivendo alla distruzione provocata dalle alte temperature. Ma se le molecole sono chirali, in questo processo può avvenire anche una separazione dei due enantiomeri, perché uno può sublimare più dell’altro, diffondendosi nell’atmosfera. In questo modo si può amplificare quello che all’inizio è solo una piccola differenza del rapporto quantitativo fra molecole L e D. La separazione seguita da arricchimento nella concentrazione di L-leucina in seguito a sublimazione è stata effettivamente osservata in condizioni sperimentali.
Tutti questi meccanismi riescono nell’insieme a spiegare come sia possibile modificare il rapporto fra amminoacidi L e D, ma non è chiaro perché alla fine abbiano selezionato proprio la forma L, che non sembra di per sé avere proprietà più adatte, rispetto alla forma D, allo svolgersi dei processi biochimici alla base della vita. Tuttavia, una volta formatesi anche le altre molecole biologiche, come l’RNA, le primordiali reazioni chimiche che hanno preceduto la nascita delle prime forme viventi, hanno favorito il propagarsi dell’enantiomero più diffuso, finché questo non è diventato quello più in uso. La relativa complessità che doveva caratterizzare già le iniziali reazioni biochimiche, doveva prevedere che le molecole fossero caratterizzate da precise conformazioni spaziali, che avrebbero poi concorso alla trasmissione delle prime informazioni genetiche. Ad essere trasmessa nel tempo fu così anche la chiralità degli amminoacidi.