I termini ‘dominante’ e ‘recessivo’ sono utilizzati in modo convenzionale per identificare le varianti di un gene. L’allele dominante mostra sempre fenotipicamente il suo effetto se presente, mentre per quello recessivo è necessaria l’assenza della variante dominante. In altre parole l’allele dominante codifica per una variante della proteina necessaria e sufficiente per determinare il fenotipo dominante. Quindi, un allele, se pur recessivo, presente sul cromosoma X sarà sempre fenotipicamente espresso negli individui maschi che lo portano, anche se presente in singola copia.
Alcuni alleli sono presenti in codominanza, cioè è possibile la presenza contemporanea di due alleli che vengono entrambi espressi, ad esempio nel gruppo sanguigno AB dove viene prodotto sia l’antigene codificato dall’allele A sia quello dell’allele B.
Fondamentalmente, un gene influisce sulla produzione di una proteina, che risulta essere quindi il tramite della sua espressione fenotipica. L’influenza di un gene può essere diretta quando codifica una proteina, o indiretta se codifica per fattori che vadano a loro volta ad agire su quella determinata proteina.
Da ciò ne deriva che la cellula non ‘sa’ se l’allele è dominante o recessivo, semplicemente trascrive e traduce i geni presenti nel proprio corredo genomico e a seconda dell’efficienza del prodotto ottenuto si avrà l’effetto fenotipico.
Per rendere più chiara la spiegazione possiamo riferirci a qualche esempio sulle combinazioni possibili di dominante e recessivo.
Autosomico (il gene è mappato su un autosoma) dominante. Ne è un esempio l’allele che codifica per la proteina huntingtina, la cui mutazione è principale responsabile della Còrea di Huntington. La proteina codificata nella forma corretta è un fattore citoplasmatico in grado di regolare l’azione di altri fattori di regolazione genica. Se presente una certa quantità di proteina non corretta, codificata da un solo allele mutato, viene alterato l’equilibrio dei fattori di trascrizione e quindi si ha lo sviluppo della sindrome.
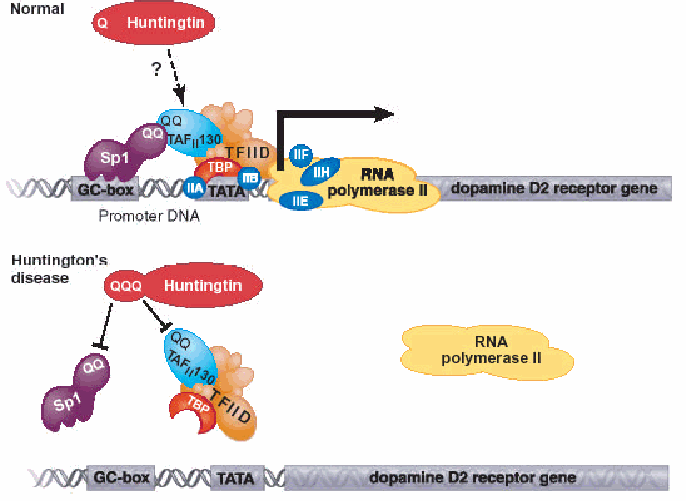
In alto: il fattore di trascrizione Sp1 si lega agli elementi del DNA chiamati GC box nei promotori cellulari. Per il reclutamento del complesso trascrizionale è richiesta un’interazione specifica proteina-proteina tra le regioni ricche in glutamina (QQ) di Sp1 e la subunità TAFII 130. Quando la protoeina huntingtina è mutata, la polimerasi II del complesso non si lega correttamente e quindi non avviene la trascrizione corretta dei geni per i recettori della dopamina. Da http://www.bio.davidson.edu/Courses/Molbio/MolStudents/spring2003/McDonald/Huntingtin.htm
Autosomico recessivo. Ne è un esempio l’allele responsabile della sindrome di Tay Sachs, mappato sul cromosoma 15. L’allele responsabile viene denominato hexA e codifica per l’enzima N-acetil-esosaminasi. Questo enzima ha il compito di tagliare un gruppo N-acetilgalattosamina terminale da un ganglioside presente a livello cerebrale. Se l’enzima non funziona, il ganglioside si accumula portando a un fenotipo estremamente grave. In questo caso, la presenza di almeno un allele non mutato e quindi la presenza di una popolazione di enzima funzionante, assicura la corretta metabolizzazione del ganglioside, scongiurandone l’accumulo e determinando quindi un fenotipo non sindromico.
Codominanza: gli alleli Ia e Ib che specificano il gruppo sanguigno. Il locus genico associato ai gruppi sanguigni AB0, determina la presenza sulla superficie dei globuli rossi di proteine con un determinato gruppo polisaccaridico. L’allele i porta alla produzione di un polisaccaride che risulta essere non antigenico. Gli alleli Ia e Ib determinano invece la formazione di due distinti polisaccaridi, che chiameremo per semplicità A e B rispettivamente, entrambi antigenici. Se è presente un solo allele Ia o Ib e il secondo allele risulta i, la popolazione proteica di superficie del globulo rosso porterà in parte il polisaccaride 0 e in parte il polisaccaride corrispondente all’allele presente (A o B). Il sangue risulterà quindi di gruppo A o B. Se però un allele è Ia e uno Ib, la popolazione proteica porterà in parte il polisaccaride A e in parte il polisaccaride B, nelle analisi quindi i globuli rossi risponderanno positivamente sia agli anticorpi anti-A che a quelli anti-B e quindi il gruppo sarà AB. Gli alleli Ia e Ib sono quindi codominanti.
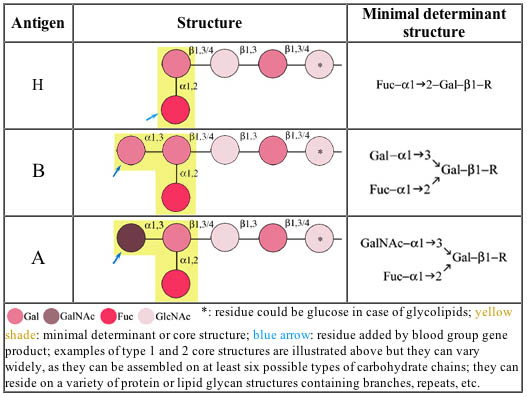
Schema riassuntivo che mostra i prodotti delle diverse varianti alleliche del locus per i gruppi sanguiigni. da
www.bioc.aecom.yu.edu/bgmut/abo.htm
Dominante legato all’X. Sono alleli abbastanza rari, uno di essi causa un difetto nella coagulazione detto trombopatia costituzionale. In questo caso il prodotto dell’allele produce una proteina alterata che impedisce la corretta formazione delle piastrine. Negli individui eterozigoti, l’allele che codifica per la proteina corretta non è sufficiente a compensare quello mutato e quindi la malattia si sviluppa.
Recessivo legato all’X. Un esempio di allele recessivo di un gene localizzato sul cromosoma X è quello responsabile dell’emofilia. Questa malattia è dovuta alla mancanza di una proteina che funziona da fattore di coagulazione. Nei maschi, l’unico gene che possa produrre questa proteina è localizzato sull’unico X presente nel loro cariotipo. Quindi, se il gene si presenta nella forma allelica mutata, allora l’individuo svilupperà la malattia. Nel caso di un individuo femmina invece, l’allele non sindromico produrrà una quantità del fattore sufficiente a una corretta coagulazione e quindi l’individuo sarà considerato un portatore sano della malattia ma non ne presenterà i caratteri fenotipici.
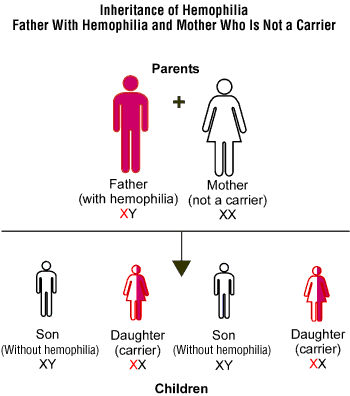
Da http://www.nhlbi.nih.gov/health/dci/Diseases/hemophilia/hemophilia_causes.html . Schema esplicativo dell’ereditarietà della mutazione che causa l’emofilia.
Legato all’Y. Un allele legato all’Y sviluppa un carattere detto oloandrico, dal momento che è presente solo negli individui maschi. In questo caso non si può parlare di dominante o recessivo, dal momento che non è mai presente una seconda copia del gene Y. Quindi il carattere si esprime fenotipicamente in maniera diretta in dipendenza della variante allelica del gene. Un esempio è l’allele che porta alla sinostosi bilaterale radio-ulnare, cioè alla fusione delle ossa radio e ulna di entrambe le braccia.
Questi sono esempi di dominanza e recessività completi, dove cioè fenotipi indotti sono facilmente distinguibili e si ripresentano sempre con le stesse caratteristiche e la stessa intensità. Esistono però molti più casi in cui c’è una vasta gamma di fenotipi dovuti a una diversa ‘efficienza’ degli alleli e a un diverso ambiente genico di contorno, in questo caso individui con la stessa combinazione allelica in un determinato locus possono presentare uno o più caratteri fenotipici diversi.
Citiamo ancora il caso di alleli a trasmissione materna, abbastanza rari e legati ad esempio al piccolo genoma mitocondriale. I mitocondri di un individuo vengono ereditati solo dalla madre, quindi gli alleli presenti nel loro genoma hanno derivazione diretta da quelli dei mitocondri materni. In questo caso è possibile avere una popolazione mitocondriale estremamente eterogenea, con una notevole varietà allelica e quindi un notevole spettro di fenotipi associati.
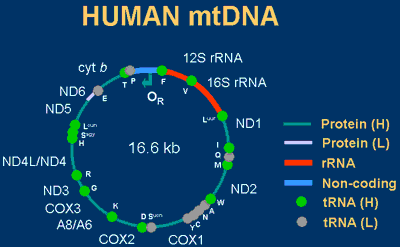
Le mutazioni nel DNA mitocondriale sono cause ben conosciute di malattie umane e solitamente portano a disfunzioni neuromuscolari e a diabete. Spesso mitocondri con DNA mutato e selvatico coesistono nello stesso individuo, nello stesso tessuto e addirittura nella stessa cellula. Gli ettetti patologici dei DNA mitocondriali mutati si osservano solo se la proporzione di mutanto supera la soglia del 60%. La proporzione tra DNA mitocondriali mutati e selvatici determinano anche la gravità del fenotipo.
http://www.mrc-dunn.cam.ac.uk/research/mtdna.html