In una pila avvengono reazioni di ossidoriduzione, che a loro volta si possono suddividere in due semireazioni che avvengono separatamente ai due elettrodi:
�
Ossidazione
-
�
Aumento del numero di ossidazione (all�anodo)
�
Riduzione
-
�
Diminuzione del numero di ossidazione (al catodo)
�
Per esempio, nella pila Daniell si ha ossidazione dello zinco da zinco metallico (Zn, con numero di ossidazione 0) a zinco ione positivo (Zn2+) con aumento del numero di ossidazione 0�> +2 e riduzione del rame da ione Cu2+ a rame metallico Cu (con numero di ossidazione 0), con riduzione del numero di ossidazione .
�
La f.e.m. (forza elettromotrice) � data dalla differenza tra i potenziali dei due elettrodi:
�
E = E0 (Cu2+/ Cu) – E0 (Zn2+/ Zn) = 0.34 – (- 0.76) = 1.1 volts
�
La reazione di ossidoriduzione che si � verificata � la seguente:
�
�� Zn�> Zn2+ + 2e– ossidazione
�
Cu2+ + 2e–�> Cu riduzione
�
La definizione di catodo e anodo risale a Michael Faraday:
�
Si definisce anodo l’elettrodo su cui avviene la reazione di ossidazione e catodo l’elettrodo su cui avviene la reazione di riduzione.
�
Pertanto il quesito contenuto nella prima parte della domanda trova risposta nella definizione stessa di anodo e catodo.
�
Per capire perch� la reazione di ossidazione avviene all’elettrodo di zinco e quella di riduzione all’elettrodo di rame, occorre riferirsi alla misura del potenziale standard di riduzione.
In una pila la semicella che ha potenziale standard di riduzione pi� basso (tenendo conto anche del segno) ha minor tendenza a ridursi, quindi sar� coinvolta dalla semireazione di ossidazione, la quale deposita elettroni sull’elettrodo, che acquista quindi segno negativo. Invece la semicella con potenziale standard di riduzione pi� alto (tenendo conto anche del segno) ha forza maggiore nel ridursi e questa semireazione sottrae elettroni all’elettrodo dandogli cos� una carica positiva.
�
Il potenziale standard di riduzione viene misurato nelle condizioni standard, concentrazione della specie chimica 1 M (1 Molare = 1 Mole /litro di soluzione) e temperatura di 25 �C (298 K).
Per esempio per le due specie chimiche presenti nella pila di Daniell i potenziali di riduzione standard valgono rispettivamente:
�
Cu++ + 2 e–�> Cu������������������������������� E0 = +0.337 V
Zn++ + 2 e–�> Zn�������������� �����������������E0 = -0.763 V
�
Il potenziale di riduzione E (espresso in Volt) varia con la concentrazione secondo la legge di Nernst:
�
�
in cui E0 (Volt) e� il potenziale di riduzione standard, F e� il Faraday (96500 C), n e� il numero di elettroni scambiati nella reazione, T e� la temperatura assoluta in gradi Kelvin e R e� la costante dei gas perfetti, a � l�attivit� della specie chimica in soluzione.
�
Il primo termine a destra del segno di uguaglianza � il potenziale di cella standard ed indicato con E�, mentre il secondo termine contiene l�attivit� (funzione della concentrazione) della specie chimica in soluzione.
L�equazione di Nernst suggerisce che si potrebbe produrre una differenza di potenziale elettrico anche sfruttando solo una differenza di concentrazione.
Consideriamo la cella presente in figura 1:
�
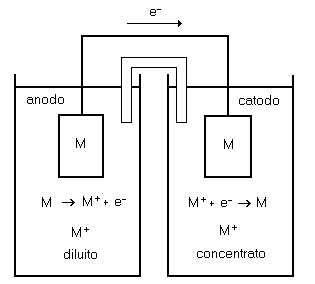 �
�Figura 1 Cella a concentrazione
Il potenziale di cella, cio� la differenza di potenziale fra la soluzione concentrata del compartimento catodico di destra e la soluzione diluita del compartimento anodico di sinistra, � calcolabile tramite la relazione di Nernst:
�E=E0-(RT/nF)*ln (a)
Pertanto mantenendo concentrazioni diverse della stessa specie chimica ai due elettrodi e� possibile ottenere una forza elettromotrice. E� il caso ad esempio delle pile al litio-ione, in cui la specie chimica che partecipa alle reazioni di ossidoriduzione e� la stessa (lo ione Li+), ma la sua concentrazione e� diversa ai due elettrodi.
Il potenziale di cella, cio� la differenza di potenziale fra la soluzione concentrata del compartimento catodico di destra e la soluzione diluita del compartimento anodico di sinistra, � calcolabile tramite la relazione di Nernst:
�E=E0-(RT/nF)*ln (a)
Pertanto mantenendo concentrazioni diverse della stessa specie chimica ai due elettrodi e� possibile ottenere una forza elettromotrice. E� il caso ad esempio delle pile al litio-ione, in cui la specie chimica che partecipa alle reazioni di ossidoriduzione e� la stessa (lo ione Li+), ma la sua concentrazione e� diversa ai due elettrodi.