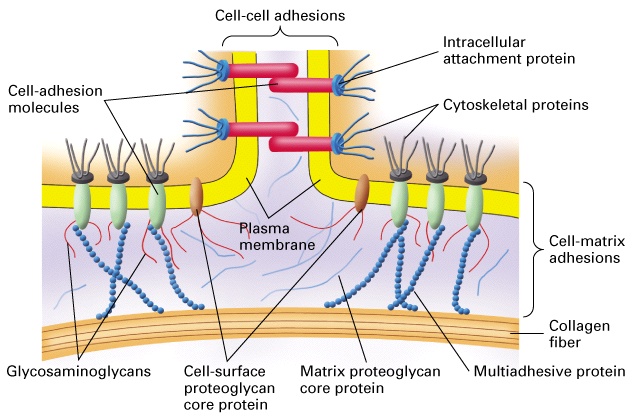
Adesione cellulare: si divide in adesione cellula-cellula e adesione cellula-substrato.
L’adesione delle cellule alle altre cellule o alla matrice che compone l’ambiente extracellulare, è mediata da proteine che possono effettuare legami omofilici o eterofilici. Le proteine con legami omofilici, si legano ad altre proteine della stessa famiglia e sono per lo più implicate nell’adesione cellula-cellula. L’adesione con il substrato viene invece attuata attraverso proteine con legami eterofilici, cioè che si legano con molecole di altre famiglie, presenti nella matrice extracellulare.
Le cellule, che costituiscono il corpo di un individuo, devono aderire alle altre cellule del proprio tessuto di appartenenza o alla matrice. Inoltre durante lo sviluppo e la migrazione devono essere in grado di muoversi ed aderire nuovamente nel corretto ambiente di destinazione. Le molecole intermediarie dell’adesione temporanea o dell’ancoraggio sono più o meno le stesse, con organizzazioni differenti.
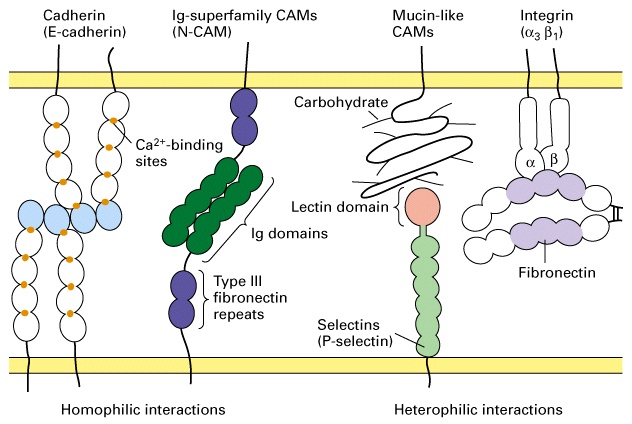
Nella maggior parte degli organismi pluricellulari, esistono due classi di molecole di adesione cellulare (CAM), una dipendente e una indipendente da calcio.
1- caderine
Sono molecole dipendenti da calcio presenti nei tessuti dei vertebrati. Inizialmente sono state nominate in base al tessuto di appartenenza: camerina-E (epitelio), camerina-N (nervi) e camerina-P (placenta). Il numero di tipi di caderine diverse è in continuo aumento, ogni tipo di cellula esprime un determinato set di caderine, che può cambiare se le funzioni della cellula cambiano. Le caderine sono per la maggior parte glicoproteine transmembrana monopasso, composte da circa 700-750 amminoacidi. La porzione extracellulare è molto estesa e composta da cinque domini di circa 100 amminoacidi. Tra questi quattro sono omologhi e contengono siti di legame per il calcio, ione indispensabile per la loro funzione. Solitamente le caderine sono impegnate in legami omofilici. Le caderine presenti sulla superficie di una cellula, cioè, legano le caderine presenti sulle superfici cellulari adiacenti.
2- Selettine
Sono molecole proteiche della superficie cellulare che legano i carboidrati e funzionano soprattutto nelle interazioni transitorie tra le cellula del sistema circolatorio. Ad esempio nel momento di contatto tra globuli bianchi e cellule endoteliali che precede la diapedesi. Le selettine sono calcio dipendenti tramite un dominio di lectina altamente conservato e legano ognuna uno specifico oligosaccaride. Ovviamente il loro legame possiede un’affinità relativamente bassa che permette ai leucociti di disancorarsi dalle cellule endoteliali senza eccessiva difficoltà.
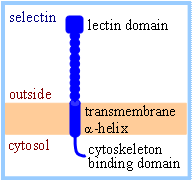
Schema di selettina da http://www.rpi.edu/dept/bcbp/molbiochem/MBWeb/mb1/part2/sugar.htm
3- N-CAM
E’ un esempio di proteine di adesione non dipendenti da calcio, che appartengono all’ampia e antica famiglia delle immunoglobuline G. N-CAM è la molecola non calcio dipendente più rappresentata nei vertebrati e agisce formando anch’essa legami omofilici. Alcune CAM non calcio dipendenti presentano comunque legami eterofilici, quali ad esempio le I-CAM delle cellule endoteliali che legano le integrine della superfice leucocitaria per intrappolare i globuli bianchi nelle sedi di infiammazione. Esistono almeno 20 tipi diversi di N-CAM, generate per lo più da splicing alternativo di un unico gene. La controparte delle N-CAM negli invertebrati è, ad esempio, la fasciciclina II di Drosophila melanogaster .
Le molecole di adesione tra cellula e cellula si possono trovare organizzate in strutture particolari sulla superficie delle cellule epiteliali. Queste strutture sono definite giunzioni cellulari e permettono all’epitelio di divenire una barriera impermeabile al mondo esterno. Le giunzioni si dividono in giunzioni occludenti e giunzioni aderenti, con la possibilità di presentarsi sotto forma di fasce lungo tutto il perimetro cellulare oppure come macule (ad esempio i desmosomi).
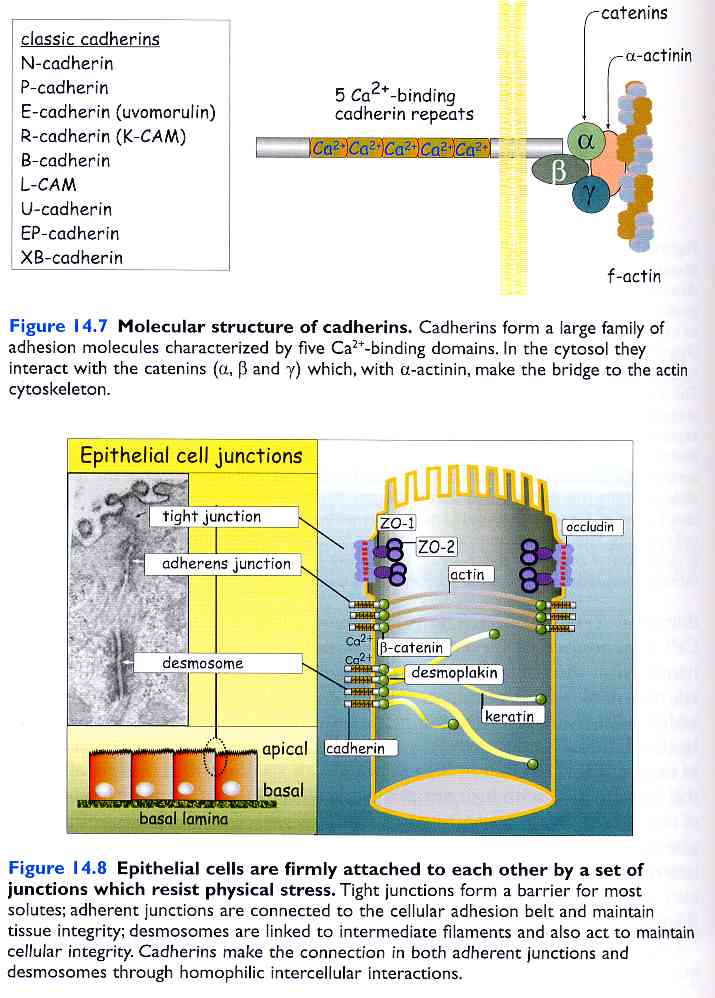
Per quanto riguarda invece l’adesione al substrato, le molecole principali coinvolte sono le integrine. Anche le integrine talvolta sono in grado di mantenere unite le cellule tramite legami eterofilici con altre molecole di superficie diverse, ma il loro ruolo principe è quello di legare le proteine della matrice extracellulare. Le integrine sono eterodimeri transmembrana, proteine di tipo recettoriale composte da due subunità glicoproteiche, α e β, associate covalentemente. Alcune integrine legano selettivamente solo un tipo di proteina di matrice, ad esempio la fibronettina o la laminino, mentre altre riconoscono il dominio RGD presente in numerose classi di molecole e quindi hanno la possibilità di interagire con numerosi componenti della matrice. Le integrine sono poi connesse nel comparto citoplasmatico con il citoscheletro, in particolare con i filamenti di actina e quindi formano una sorta di ponte che permette alla cellula di comunicare e interagire con la matrice. Le integrine si trovano disperse sulla superfice o organizzate in una struttura particolare, l’emidesmosoma, che rientra nella classe delle giunzioni di membrana.
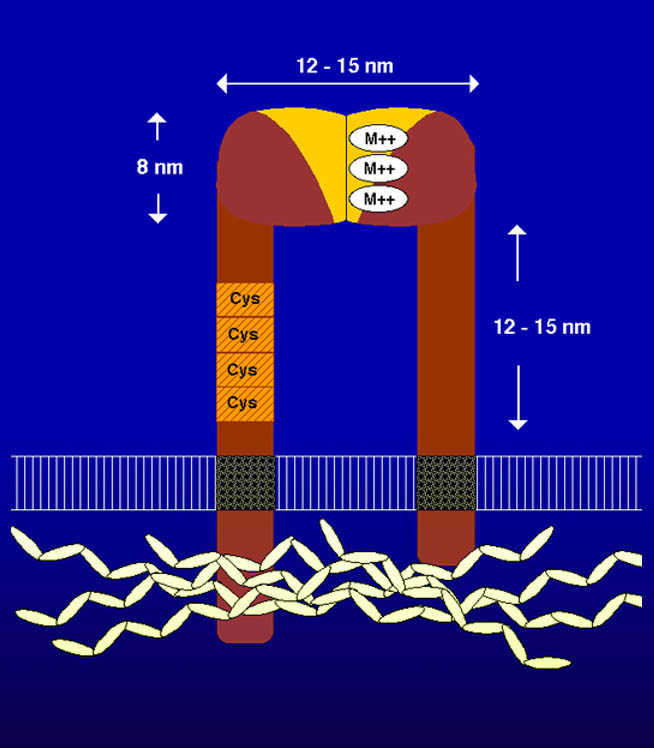
Schema di un’integrina. Da http://www.uic.edu/dent/oralbio/jxlilab.html
Questo è un buon link in inglese, dal quale sono state prese alcune delle immagini precedenti.
http://bioweb.wku.edu/courses/biol566/L21AdhesionSigTransdctn.html