Uovo e spermatozoo. Da http://www.mun.ca/biology/desmid/brian/BIOL3530/DB_Ch12/DBNGerm.html
L’attivazione della cellula uovo consiste in una serie di eventi successivi alla fecondazione che hanno lo scopo di preparare la cellula stessa a iniziare la sua attività di zigote e quindi di embrione. In generale l’attivazione prevede il blocco della polispermia, la preparazione alla fusione dei due pronuclei e l’inizio della traduzione degli mRNA materni e della trascrizione dei geni zigotici.
Tra questi, il processo più repentino e immediatamente visibile è il blocco della polispermia, specialmente nelle uova del riccio di mare e dei pesci, che sono, peraltro, le più studiate nell’ambito della fecondazione.
Il blocco della polispermia avviene attraverso il processo di innalzamento della membrana di fecondazione a seguito dell’esocitosi degli alveoli corticali, che crea una sorta di camera a dividere la membrana della cellula uovo dagli altri spermatozoi. L’innalzamento avviene a seguito dell’ingresso del primo spermatozoo, inizia proprio nel punto del suo ingresso e si espande velocemente a tutta la superficie della cellula. Quindi, è questo processo che viene utilizzato come indicatore dell’avvenuta attivazione dell’uovo.
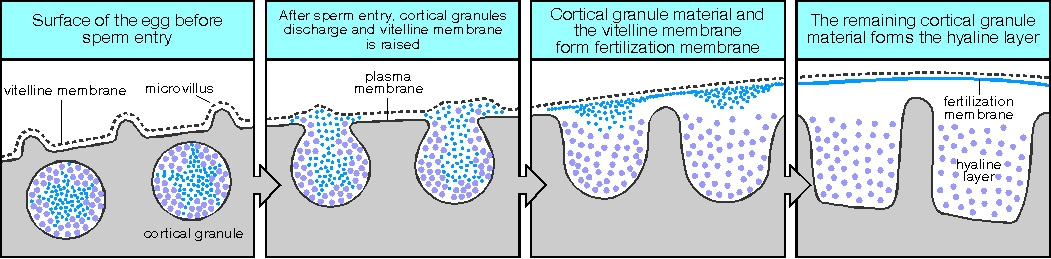
Rottura dei granuli corticali e sollevamento della membrana di fecondazione.
Da http://www.mun.ca/biology/desmid/brian/BIOL3530/DB_Ch12/fig12_24.jpg
Gli studi principali sull’attivazione sono stati svolti nel riccio di mare, ad es. il Paracentronotus lividus, e i pesci, quali Oryzias latipes e Brachidanio rerio.
Gli esperimenti svolti prevedevano l’utilizzo di differenti meccanismi per individuare la causa scatenante l’attivazione. Quando uno spermatozoo penetra all’interno dell’uovo, quest’ultimo è sottoposto a differenti stress, principalmente meccanici e chimici.
Forniremo qui un elenco degli stress utilizzati negli esperimenti e della loro efficacia.
Attivazione tramite stress meccanico.
L’uovo in questo caso viene punto da un sottile ago in vetro di 15-20 micron di diametro, in modo da simulare l’ingresso dello spermatozoo. Gli alveoli corticali si rompono nel punto in cui è penetrato l’ago e il processo continua da questa regione fino al polo opposto.
Attivazione tramite sostanze chimiche
Sono state utilizzate differenti sostanze chimiche che agiscono sulla superficie dell’uovo quali:
– sodio taurocolato 1%
– sodio glicocolato 1%
– sodio oleato 1%
– saponina 0,1%
– digitalina 0,01%
Sono stati testati anche diversi detergenti:
– Aerosol OT 0,01%
– Monogen 0,5%
– Nekal BX 0,05%
– Labolan 0,05%
Alcuni acidi inorganici alla concentrazione di 10-3 N
– HCl
– H2SO4
– HNO3
E alcuni acidi grassi:
– acido formico
– acido acetico
– acido propionico
Tutte queste sostanze si sono rivelate attivatori efficienti, probabilmente emulsionando la superficie citoplasmatica. Si sono invece rilevati inibitori dell’attivazione gli acidi butirrico e valerico.
Attivazione termica
Esperimenti compiuti su uova di pesce hanno dimostrato che possono essere attivate attraverso una breve esposizione a temperature elevate (45°C per 30 sec-4min).
Attivazione elettrica
L’attivazione elettrica causa attivazioni in due modi differenti a seconda dell’intensità del campo elettrico. Se il campo è maggiore di 2 volt per centimetro, la rottura degli alveoli con la successiva separazione del corion, avviene sia all’anodo che al catodo. Quando l’asse che connette il polo vegetale e animale dell’uovo si trova posizionato a 90° rispetto alle linee del campo, l’innalzamento della membrana avviene prima all’anodo che al catodo. Se invece l’asse è parallelo alle linee di campo, l’effetto è più rapido quando il polo animale è diretto verso l’anodo.
Attivazione fotodinamica
In questo caso le uova vengono immerse in sostanze fluorescenti quali la rodamina B o l’eosina ed esposte a raggi ultravioletti. In questo caso l’attivazione coinvolge un elevato numero di uova ma non tutte.
Attivazione supersonica
Vengono utilizzate onde supersoniche per interferire con la superficie delle uova. Anche in questo caso l’efficienza non è del 100%
L’attivazione in vitro scatena l’inizio di una catena di eventi, talora si arriva persino alle prime divisioni della segmentazione (pseudosegmentazione) ma ovviamente lo sviluppo si arresta precocemente.
Spesso manca una spiegazione precisa per gli effetti dell’attivazione dell’uovo causata da alcuni stress. Comunque l’effetto è sempre collegato alla serie di cambiamenti che avvengono normalmente dopo la fecondazione. Primo fra tutti è l’innalzamento della concentrazione di calcio all’interno della cellula uovo. Infatti i primi esperimenti di attivazione in vitro su riccio di mare avevano utilizzato proprio uno ionoforo per il calcio, A23187, che causava ingresso di questo ione dall’acqua di mare verso il citoplasma e il successivo innalzamento della membrana di fecondazione. Nel riccio di mare, nella rana e nei pesci è stata visualizzata un’unica intensa onda di rilascio del calcio dopo la fecondazione, mentre in ascidie, mammiferi, nemertini e vermi si assiste a oscillazioni periodiche prolungate nel tempo.
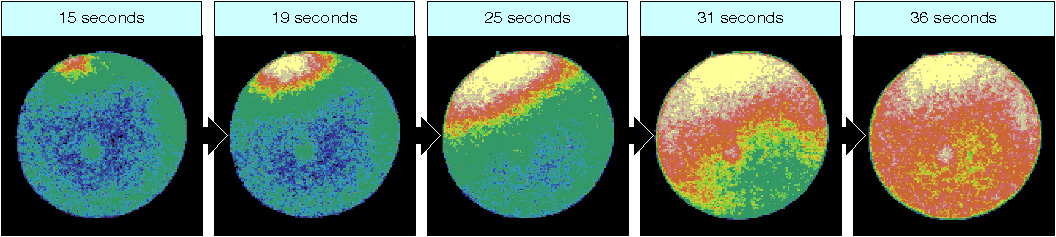
Visualizzazione dell’onda di calcio a seguito dell’ingresso dello spermatozoo.
Da http://www.mun.ca/biology/desmid/brian/BIOL3530/DB_Ch12/DBNGerm.html
Per quanto riguarda il meccanismo di rilascio del calcio, si è presupposto un coinvolgimento dell’inositolo trifosfato (IP3), il cui incremento porterebbe all’attivazione dei recettori specifici posti sulle membrane degli orfanelli di deposito del calcio. Tuttavia non si può escludere un ruolo per altri messaggeri intracellulari quali l’ADP ribosio ciclico (cADPR), l’acido nicotinico adenin-dinucleotide fosfato (NAADP), l’ossido nitrico (NO) e il GMP ciclico (cGMP). Alcuni autori hanno anche proposto che lo spermatozoo rilasci all’interno dell’uovo un fattore solubile che scatenerebbe gli eventi tardivi della fecondazione. Per quanto riguarda i mammiferi, questo fattore spermatico sembra essere stato identificato in una fosfolipasi C.
Su questo argomento comunque esiste ancora un certo dibattito e nuove scoperte arricchiscono continuamente il quadro degli eventi successivi alla fecondazione.