Solitamente, per una certa sostanza, lo stato solido ha una densità maggiore di quello liquido. Ciò è dovuto al fatto che mentre in un liquido le molecole posso scorrere una sulle altre, in un solido sono “costrette” a rimanere vicine da forze coesive.
L’acqua presenta invece una caratteristica insolita rispetto alle altre: allo stato solido è meno densa che allo stato liquido. Questo perché le molecole di acqua, nel reticolo cristallino del ghiaccio ordinario (esagonale bipiramidale) si dispongono in modo da lasciare degli spazi vuoti, e quindi in un volume di acqua liquida ci saranno più molecole che nello stesso volume di ghiaccio:
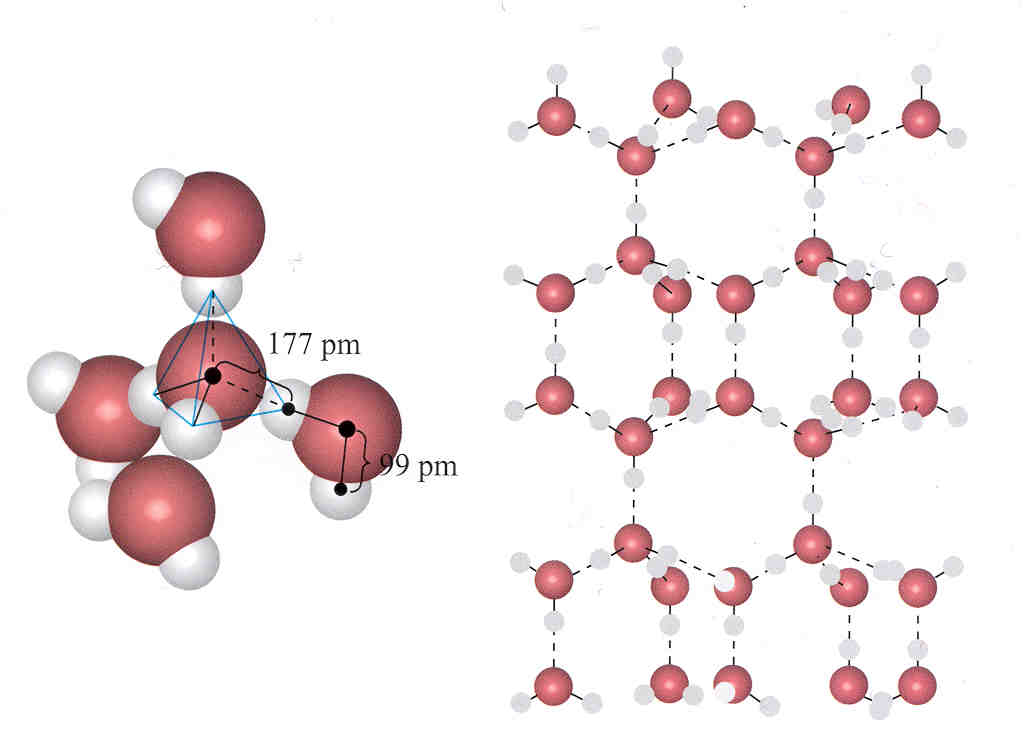
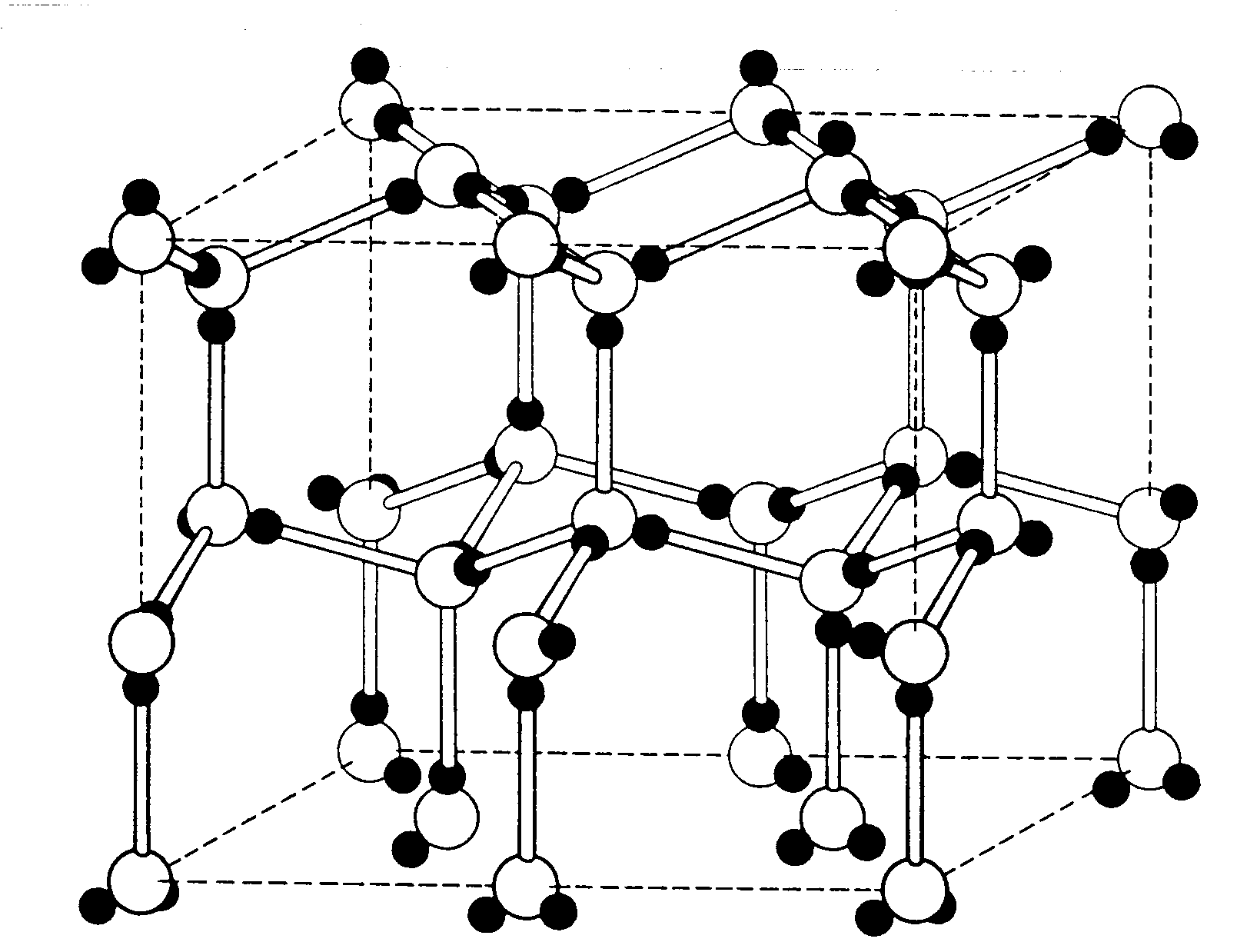
Reticoli cristallini del ghiaccio
A 4°C (per la precisione a 3,945°C) e a pressione normale (1 atmosfera) l’acqua raggiunge il massimo della sua densità, per poi scendere. Qui sotto sono riportati alcuni valori numerici:
|
Temperatura (°C) |
Densità (g/mL) |
|
0 |
0.99982 |
|
4 |
0.99997 |
|
20 |
0.99829 |
|
50 |
0.98802 |
|
100 |
0.95805 |
Le conseguenze di questo comportamento sono molto importanti: se il ghiaccio non galleggiasse sull’acqua, esso ricoprirebbe progressivamente il fondale marino, bloccando i flussi delle correnti marine, impedendo la vita degli organismi acquatici e provocando il raffreddamento del pianeta. Il ghiaccio quindi rimane in superficie mentre l’acqua, meno fredda ma più densa, va sul fondo creando correnti convettive che uniformano la temperatura.
Per un approfondimento si possono consultare i seguenti link: