– Breve storia e sintesi industriale del fenolo
Il fenolo è uno tra i più semplici derivati del benzene e il capostipite
della classe che da esso prende il nome. Ha formula C6H5OH,
è un solido cristallino bianco dal caratteristico odore. Fu scoperto da
Runge nel 1934 nel catrame di carbon fossile; pochi anni dopo Lister ne
riconobbe le proprietà antisettiche e ne consigliò l’uso prima degli
interventi chirurgici. Sebbene non venga praticamente più impiegato a
questo scopo e sia stato soppiantato da prodotti meno caustici e
tossici, è tuttora prodotto e molto usato per produrre plastiche,
coloranti e farmaci. Nell’ industria, il fenolo viene convenientemente
preparato passando attraverso la formazione di un intermedio, il cumene
o isopropilbenzene, partendo da benzene e propilene tramite una normale
reazione di sostituzione elettrofila aromatica (in questo caso si tratta
di un’alchilazione di Friedel-Crafts) catalizzata da un acido di Lewis
quale l’alluminio tricloruro o l’acido fosforico, più economico del
precedente e quindi industrialmente preferito; la reazione viene
normalmente condotta in fase gassosa, a 250°C e alla pressione di 30
atmosfere. Il meccanismo è il seguente:
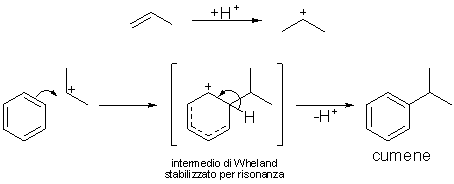
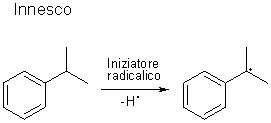
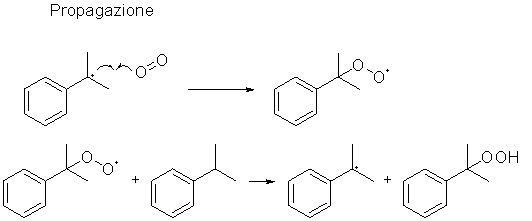
Lo stadio successivo prevede l’ossidazione del cumene da parte
dell’ossigeno dell’aria in presenza di quantità catalitiche di
iniziatore radicalico (benzoil perossido, ad esempio) ed in condizioni
lievemente basiche (i doppietti elettronici sono stati omessi per
chiarezza):
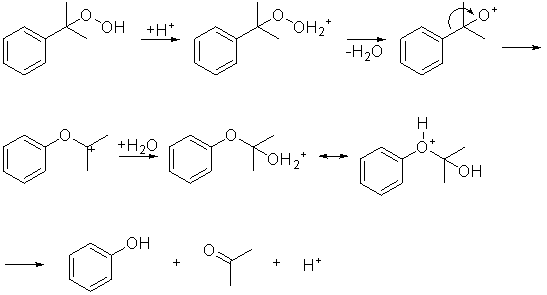
Il cumene idroperossido viene quindi idrolizzato in ambiente acido per
dare fenolo e acetone, tramite trasposizione dell’intermedio che si
forma:
La maggior parte del fenolo e dell’acetone viene usata nella sintesi del
bisfenolo A, un monomero base per la produzione di resine epossidiche e
plastiche al policarbonato (CD, vetri di sicurezza, lenti per occhiali
da sole, rivestimenti, contenitori per liquidi e cibi, ecc…)
– Sintesi di laboratorio
Sebbene il database Beilstein di chimica organica riporti svariate
procedure (se ne contano poco più di 80) per la conversione del benzene
a fenolo in un unico stadio, in laboratorio il fenolo non viene ottenuto
direttamente da questo, a meno di non dover preparare dei derivati
particolari. E’ possibile applicare in laboratorio la sintesi del fenolo
dal cumene, che in questo caso è preparato per alchilazione del benzene
con n-propil cloruro in presenza di alluminio tricloruro. L’uso di un
alogenuro lineare è previsto in quanto si forma comunque il carbocatione
secondario, più stabile (per effetto iperconiugativo):

La sintesi più comune del fenolo in laboratorio viene comunque fatta per
diazotazione dall’anilina. Per produrre quest’ultima, si nitra il
benzene con una miscela di acido nitrico e acido solforico, quindi si
riduce con stagno (o ferro) e acido cloridrico, oppure per idrogenazione
catalitica, o ancora usando idruri metallici. Di seguito è presentato
uno schema dei due passaggi:
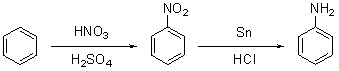
Queste sono tipiche procedure per la produzione di nitrobenzene (1) e
anilina (2) in laboratorio (NOTA: le quantità sono state omesse per
ragioni di sicurezza, e si sconsiglia di provare tali procedure se non
adottando le dovute precauzioni e soprattutto avvalendosi di personale
competente):
1) In
un pallone munito di termometro viene posto acido nitrico concentrato,
si raffredda in un bagno d’acqua e ghiaccio e si aggiunge acido
solforico concentrato a piccole porzioni e sotto agitazione. Si
introduce il benzene a piccole porzioni, evitando che la temperatura
superi i 55°. Al termine dell’aggiunta, si monta un refrigerante a
ricadere e si scalda a 60°C per 40-45 minuti. Al termine, si versa tutto
con cautela in acqua fredda, agitando in modo che il nitrobenzene venga
lavato bene dai residui acidi. Si lascia separare le fasi (il
nitrobenzene, essendo più denso, rimane sul fondo) e si elimina la fase
acquosa acida superiore. Si trasferisce il nitrobenzene in un imbuto
separatore e si lava con acqua. Si essicca il nitrobenzene su cloruro di
calcio anidro e si filtra. Il liquido viene quindi distillato
raccogliendo la frazione che bolle tra 206 e 211 °C; ottenendo così un
liquido giallo pallido e trasparente. Non bisogna superare i 214°C né
distillare a secchezza in quanto il residuo, composto da prodotti di
nitrazione superiore, può esplodere. Si ricorda che il nitrobenzene è
tossico.
2) In
un pallone munito di refrigerante a ricadere viene posto il nitrobenzene
precedentemente preparato e stagno in granuli. Dal condensatore viene
aggiunto con estrema cautela acido cloridrico concentrato a piccole
porzioni: la miscela diventerà rapidamente calda, ed occorre raffreddare
il pallone prima di ogni successiva aggiunta e mai se la miscela è
troppo calda o inizia a bollire. Terminata l’aggiunta si scalda a 100°C
per 30-60 minuti. A temperatura ambiente, si aggiunge cautamente una
soluzione di idrossido di sodio in di acqua evitando di portare a
ebollizione la miscela. Si distilla in corrente di vapore raccogliendo
solo la coda. A causa della seppur bassa solubilità dell’anilina in
acqua, essa dev’essere “strippata” per salatura. Il distillato così
saturato viene estratto in imbuto separatore con etere dietilico e la
fase organica essiccata con carbonato di potassio anidro (il calcio
cloruro non può essere impiegato perché reagisce con l’anilina). Dopo
aver filtrato via il solido, si rimuove l’etere per distillazione oppure
usando un evaporatore rotante, quindi si distilla l’anilina raccogliendo
la frazione tra 180 e 184 °C. Anche l’anilina è tossica.
L’anilina così prodotta viene sottoposta alla reazione di diazotazione,
processo molto versatile per produrre una grande varietà di composti:
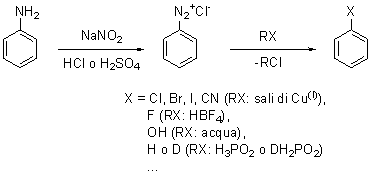
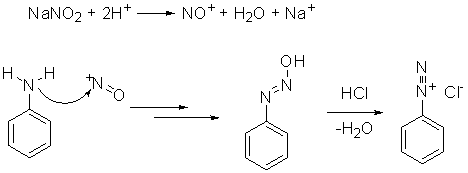
In questo caso, si usa un nitrito (comunemente di sodio) e acido
cloridrico o acido solforico a bassa temperatura; un meccanismo – molto
semplificato – comunemente accettato (poiché non ancora completamente
compreso a fondo) è il seguente:
Successivamente, riscaldando il sale di diazonio in acqua si ottiene il
fenolo:
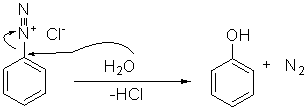
Una procedura tipica è la seguente:
In un pallone si pone acqua e acido solforico concentrato (mai
viceversa), e anilina, riscaldando se necessario per facilitarne la
dissoluzione. Si aggiunge acqua fredda e si pone in un bagno di
ghiaccio, in modo che la temperatura scenda al di sotto dei 5°C e
agitando vigorosamente per separare l’anilina solfato in cristalli
finemente suddivisi. Si aggiunge lentamente una soluzione acquosa di
nitrito di sodio: il solfato di anilina si discioglie rapidamente
durante la reazione. Per determinare la fine della reazione si può
prendere una goccia di miscela e farla reagire con una soluzione di
ioduro di potassio, quindi aggiungere della salda d’amido: se la
soluzione diventa nera la diazotazione è completa. Si lascia reagire per
15-20 minuti, quindi si scalda a 50°C per circa 15 minuti, o comunque
finché cessa l’evoluzione di azoto. Si distilla in corrente di vapore e
si “strippa” via l’acqua come visto precedentemente, estraendo poi con
etere e seccando su potassio carbonato o magnesio solfato anidri. Si
distilla quindi il fenolo raccogliendo la frazione tra 179 e 183 °C. Il
fenolo fonde a 43°C, quindi per raffreddamento cristallizza nel
recipiente di raccolta. Il fenolo ha azione corrosiva sulla pelle e
sulle mucose.
La strada così percorsa che porta da benzene a fenolo, nonostante
richieda tre passaggi, viene comunemente usata per la produzione di
derivati del benzene anche complessi, variando in modo opportuno le
condizioni di lavoro, poiché si utilizzano processi relativamente
semplici e facilmente scalabili, con reagenti economici, stabili e
largamente disponibili, e arrivando a rese di reazione più che
soddisfacenti.
Ci sono altri due importanti metodi indiretti di preparazione del
fenolo:
a) si passa attraverso la sintesi dell’acido benzensolfonico, usando
benzene e oleum, ovvero anidride solforica disciolta in acido solforico
concentrato. L’acido benzensolfonico viene quindi sottoposto a fusione
alcalina con sodio idrossido ad alta temperatura:
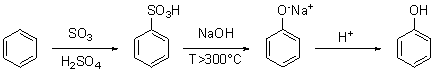
b) un metodo applicabile anche industrialmente (processo Raschig-Hooker)
prevede la fusione alcalina del clorobenzene in condizioni analoghe al
metodo precedente. Il clorobenzene si sintetizza da benzene e cloro,
usando un acido di Lewis quale ferro tricloruro come catalizzatore; si
può anche usare direttamente ferro e formare il catalizzatore in situ:
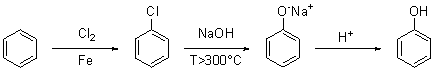
—
Fonti:
– Practical Organic Chemistry, Vogel
– Chimica Organica, Baker & Engel
– Wikipedia (http://en.wikipedia.org)