I dischi intercalari, chiamati anche strie scalariformi, sono una caratteristica del muscolo striato cardiaco che è possibile notare anche al microscopio ottico. Microscopicamente, appaiono come zone ispessite localizzate al confine tra i cardiociti, parallelamente all’andamento della striatura dei cardiociti stessi. Il tessuto muscolare cardiaco è formato da cardiociti mono o binucleati, di forma più o meno allungata, che spesso assumono una forma a Y o a X, strettamente connessi tra di loro sia meccanicamente che fisiologicamente. La presenza di una membrana che circonda il singolo miocita, gli permette di lavorare come un’unità contrattile autonoma. Tuttavia per produrre il battito, le capacità contrattili di miliardi di miociti che costituiscono il cuore devono essere sincronizzati. Questo richiede una diffusione ordinata dello stimolo elettrico e una trasmissione efficiente della forza contratile da una cellula alla successiva; i dischi intercalari hanno proprio la funzione di rendere possibile questi eventi.
Schema generale del cuore. da http://sprojects.mmi.mcgill.ca/cardiophysio
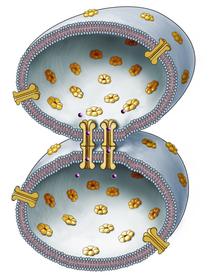
Le membrane dei dischi sono connesse fisicamente da tre tipi di giunzioni:la giunzione comunicante, la fascia aderente e il desmosoma. La fascia aderente e il desmosoma sono giunzioni ancoranti, responsabili della connessione meccanica tra i miociti. Sia il desmosoma che la fascia aderente presentano sul versante extracellulare delle proteine di adesione che si chiamano caderine, mentre sul versante citoplasmatico mostrano diversi tipi di proteine fibrillari e non connesse al citoscheletro. Le giunzioni comunicanti sono essenzialmente raggruppamenti di canali che attraversano le membrane ravvicinate di due cardiociti, formando vie transcellulari per la conduzione rapida dei potenziali di azione e la trasmissione diretta dei segnali chimici.
Schema dell’organizzazione di una giunzione comunicante. da Severs, 2000.
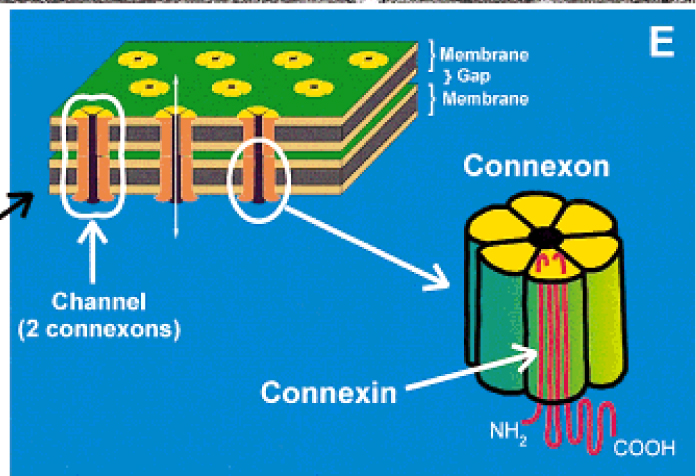
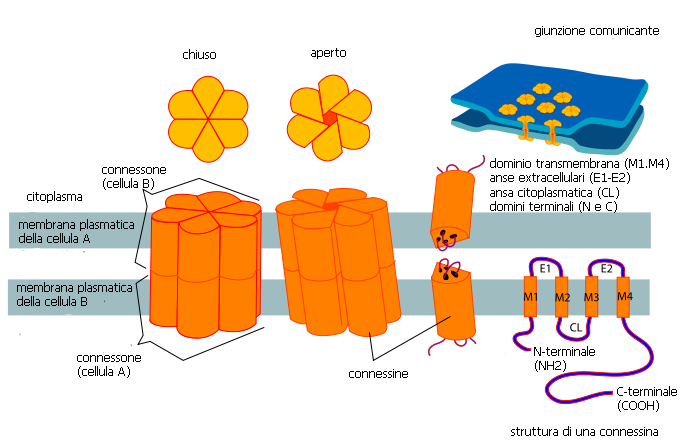
Le immagini di ultrastruttura hanno mostrato la presenza di un grande anello di giunzioni gap alla periferia del disco, che circonda numerose giunzioni più piccole centrali. L’organizzazione e la distribuzione di questi raggruppamenti ad anello delle giunzioni comunicanti partecipano alla diminuzione della resistenza alle correnti elettriche lungo l’asse longitudinale della cellula. Un singolo canale comprende un paio di connessoni coassiali (emicanali) che attraversano lo steretto spazio extracellulare. I canali delle giunzioni comunicanti sono permeabili agli ioni e alle piccole molecole fino a 1 kDa di massa molecolare, una dimensione che include i secondi messaggeri quali l’inositolo trifosfato, l’AMP ciclico e il calcio. Un singolo connessone è costituito da sei proteine chiamate connessine, l’intero canale da dodici. Le connessine non sono tutte uguali: ad oggi sono stati identificati 16 geni differenti nelle cellule dei mammiferi e la maggior parte dei tessuti, compreso quello cardicaco, esprimono più di un tipo di connessina. Nel cuore, la connessina più diffusa è la connessina43, una isoforma identificata per la prima volta da Rob Gourdie.
Schema di giunzione comunicante tra due cellule. da http://www.marketwire.com
Le molecole di connessina possiedono quattro porzioni transmembrana e due anse extracellulari, più una singola ansa e le code carbossi e amminoterminali nel lato citoplasmatico. Le anse extracellulari sono regioni conservate che permettono l’ancoraggio selettivo tra i connessoni. La chiusura del canale può essere influenzata da un cambiamento nella conformazione delle proteine del canale o, talvolta, da domini specifici all’estremità carbossiterminale che possono arrotolarsi verso l’alto a bloccare il poro. Queste modalità di controllo del passaggio sono regolate dal voltaggio, dal pH intracellulare, dalla concentrazione del calcio e dallo stato di fosforilazione delle connessine. Sebbene la connessina 43 sia la più abbondante nei cardiociti del ventricolo e dell’atrio nei mamiferi, è nota la presenza in alcune zone specifiche della connessina40 e della connessina 45.
modificato da http://de.wikipedia.org/wiki/Connexin
Le varie popolazioni di cardiociti che si localizzano nelle diverse regioni del cuore presentano caratteristiche elettrofisiologiche loro proprie. Queste caratteristiche vengono definite sia dalla dimensione, dalla distribuzione e dal’abbondanza delle giunzioni comunicanti, sia dal tipo di connessine che le compongono. Possiamo citare come esempio Il cardiocita ventricolare, che è responsabile delle contrazioni forti che spingono costantemente il sangue attraverso il sistema vascolare. La sua controparte nell’atrio, la cui azione facilita il riempimento del ventricolo, è una cellula lunga e sottile, che svolge anche il ruolo di cellula secretoria, producendo l’ormone ANP. Un terzo gruppo di cardiociti, abbastanza eterogeneo, genera l’impulso e gestisce il sistema di conduzione. Queste ultime cellule sono responsabili della generazione dell’impulso e della sua distribuzione temporizzata alle cellule delle camere nel momento appropriato del ciclo cardiaco.
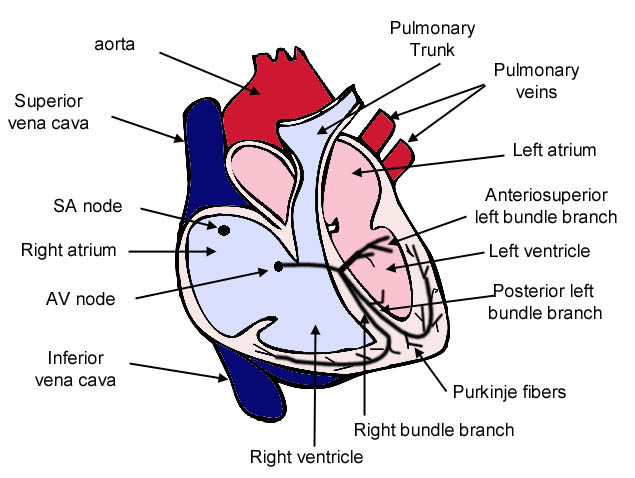
L’impulso cardiaco viene generato nel nodo senoatriale da dove attraversa e attiva l’atrio, prima di convergere sul nodo atrioventricolare per la distribuzione nel ventricolo attraverso un sistema di conduzione specializzato. I miociti che generano l’impulso e che organizzano il sistema di conduzione differiscono morfologicamente dai miociti della contrazione. Quelli dei nodi sono tipicamente di dimensioni inferiori, con giunzioni comunicanti piccole e rare. Queste caratteristiche sono correlate con la capacità del nodo senoatriale di gestire l’ampia massa di tessuto sottostante rimanendo protetto dalla sua influenza iperpolarizzante e, nel nodo atrioventricolare, con una bassa conduzione che assicura la contrazione sequenziale di atri e ventricoli.
La capacità del sistema delle fibre di Purkinje di distribuire l’impulso rapidamente attraverso il tessuto contrattile del miocardio, si correla con la presenza di giunzioni comunicanti ampie e abbondanti e con elevati livelli di connessina40, una connessina che origina canali ad elevata conduttività. I miociti contrattili del ventricolo solitamente mancano di connessina 40, mentre questa è presente nei miociti striali di molte specie di vertebrati.
La connessina45, una proteina che forma canali a bassa conduttanza, è presente solo in piccole quantità. Questa connessina è tipicamente irrilevabile o pochissimo presente nei miociti ventricolari, mentre è presente a livelli abbastanza alti nell’atrio. Nel ventricolo dei roditori, la connessina45 è principalmente espressa nel sistema di conduzione dove co-localizza con la connessina40. Queste due connessine sono le principali costituenti delle piccolissime giunzioni comunicanti presenti sia nel nodo senoatriale sia in quello atrioventricolare.
Nel sistema di conduzione del ratto, la zona di co-esopressione delle connessine 40 e 50 forma un sottocompartimento circondato da una zona in cui si trova solo la connessina 45. Il nodo senoatriale del coniglio,mancante di connessina 43, è chiaramente diviso dal miocardio circostante eccetto per una zona ristretta di co-espressione della connessina 45 e della connessina 43 al confine tra i nodi e la cresta terminale, zona che costituisce una possibile via per l’uscita diretta dell’impulso dal nodo nel tessuto atriale.
Questo esempio spiega come l’espressione spaziale della connessina, con differenti proprietà di accoppiamento intercellulare con i secondi massaggeri e di compatibilità con le altre isoforme, possa permettere una comunicazione elettiva tra compartimenti del tessuto funzionalmente diversi.
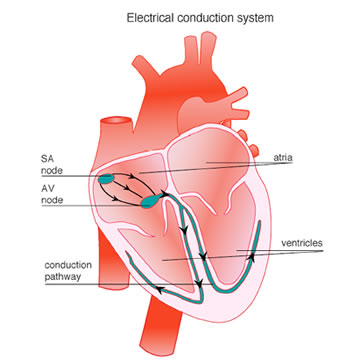
Schema delle regioni implicate nella conduzione elettrica nel muscolo cardiaco. da http://www.nhf.org.nz
Non tutte le combinazioni di connessine sono compatibili (cioè in grado di formare canali funzionali); un connessone di connessina40, ad esempio, non può ancorarsi con un connessone con connessina 43, mentre un connessone formato da connnessina45 può ancorarsi a entrambi. La presenza di connessina45 nella zona di transizione tra il sistema di conduzione/generazione dell’impulso e il miocardio contrattile è interessante per la capacità di questa connessina di legarsi nelle zone che esprimono connessina 40 e connessina43, che in altro modo sarebbero incompatibili.
Nelle cellule che esprimono più di un tipo di connessina, tuttavia, è possibile una molteplicità di organizzazioni differenti che coinvolgono canali eterotipici (quello che comprendono un conessone costituito da un solo tipo di connessine, che si associa con un secondo connessone costituito da un tipo di connessina differente), i canali omotipici (quelli in cui è presente un solo tipo di connessina in entrambi i connessoni) o i canali eterodimerici (nei quali il connessone stesso contiene una miscela di connessine). E’ interessante che alcune combinazioni eterotipicne di connessoni (incluse quelle che coinvolgono la connessina43 e la connessina45) mostrino dipendenze da voltaggio asimmetriche tra i due lati del canale.
La disorganizzazione delle giunzioni comunicanti, oltre ad alterare l’eccitabilità della membrana, possono quindi contribuire in linea di principio a perturbazioni pericolose del ritmo cardiaco (Aritmie) che si ritrovano nel caso di sindromi cardiache. La maggior parte delle aritmie ventricolari nelle sindromi cardiache umane sono dovute a circuiti elettrici ricorrenti (nei quali l’impulso descrive un cortocircuito automantenuto). Circuiti ricorrenti di grande portata possono derivare da porzioni di tessuto con giunzioni comunicanti anomale posizionate tra l’atrio e il ventricolo, che bypassano il nodo atrioventricolare, una condizione chiamata sindrome di Wolff-Parkinson Whithe. Le aritmie da micro cortocircuiti comuni nei pazienti con sindromi ipertrofiche e ischemiche cardiache (la forma più comune di sindrome cardiaca derivata dall’occlusione delle arterie coronariche) sono caratterizzate da una conduzione anormalmente lenta,da onde di propagazione eterogenee e da blocchi unidirezionali localizzati, dovute al ridotto accoppiamento delle giunzioni comunicanti, ridotta eccitabilità di membrana e/o architettura istologica alterata.
Quando nelle sindromi cardiache ischemiche avviene un infarto miocardio non fatale (morte e degradazione di una porzione di tessuto cardiaco), nella zona miocardia di confine del tessuto infartuato si registra la perdita della normale distribuzione ordinata di giunzioni comunicanti contenenti connessina43. Nelle cellule di questa zona, le giunzioni comunicanti sono distribuite in maniera anomala sul compartimento laterale della membrana plasmatica, mentre in quelle più distanti dal sito le giunzioni restano chiaramente ordinate in righe nel disco intercalare.
Propongo due link di approfondimanto, uno generico sulla struttura delle cellule muscolari e un secondo più specifico del tessuto cardiaco.