Si tratta della “solvatazione”, effetto che risulta più intenso quanto maggiore è la densità di carica dello ione. Questa tendenza dei cationi a sussistere nello stato solvatato permane anche quando essi entrano a far parte di una struttura cristallina. Ad esempio nei solfati, come CuSO4*5H2O o MgSO4*7H2O o ancora nel gesso CaSO4*2H2O, ma lo stesso processo è osservabile anche in certi carbonati.
L’acqua di cristallizzazione (alcuni preferiscono chiamarla di idratazione), grazie al suo carattere dipolare, si lega ai cationi metallici; questi ultimi tendono infatti a coordinare geometricamente intorno a se stessi le molecole dipolari. Nel caso in cui il numero delle molecole d’acqua disponibile sia inferiore al numero di coordinazione del catione metallico, il metallo può coordinare non solo molecole di acqua ma anche ossigeni facenti parte di gruppi anionici. Sono possibili anche casi inversi, ad esempio di sali idrati contenenti molecole di H2O in eccesso rispetto alla coordinazione del catione metallico, con la conseguenza che sicuramente almeno alcune delle molecole d’acqua non fanno parte dei poliedri di coordinazione.
Tale fenomeno può essere spiegato o ammettendo che la molecola d’acqua sia contenuta in posizioni reticolari definite e tali da consentire la formazione di legami idrogeno, oppure che la stessa sia dispersa nei vuoti che si originano all’interno della struttura considerata senza alcuna funzione strutturale.
Nelle zeoliti, silicati in cui i gruppi tetraedrici formano un reticolato tridimensionale per compartecipazione dei vertici, l’impalcatura è tale da consentire la formazione di spazi liberi entro i quali possono facilmente collocarsi le molecole di H2O. Le zeoliti sono dunque composti non stechiometrici ed il loro stato di idratazione dipende generalmente dalla pressione parziale di vapor d’acqua nell’atmosfera in equilibrio con i cristalli. Naturalmente nei canali trovano posto non solo le molecole di acqua ma anche i cationi di bilanciamento. E i cationi presenti nei canali sono solvatati cioè circondati da molecole di acqua.
Tuttavia la proprietà caratteristica di questi minerali è l’enorme forza con la quale assorbono acqua e la trattengono, qualora siano disidratati. La zeolite disidratata e raffreddata è avidissima di acqua; è quindi un forte disidratante che tende ad idratarsi fino ad aver riassorbito una notevole frazione della massima quantità d’acqua che può essere contenuta nei suoi canali. Si tratta quindi di un processo di idratazione anche se all’interno dei canali possono entrare dei cationi che saranno a loro volta solvatati.
Con il termine idratazione si può quindi definire l’incorporazione di molecole d’acqua o di ossidrile nella struttura dei minerali, fenomeno ben diverso dalla solvatazione che come abbiamo visto si mantiene chimicamente anche all’interno delle strutture cristalline.
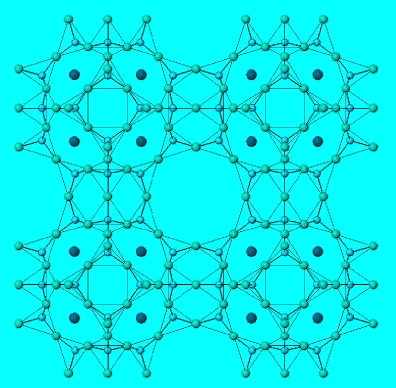
Fig. 1: Struttura delle zeoliti: impalcatura tridimensionale tetraedrica. Secondo il tipo di struttura contengono canali regolari o pori interconnessi. I pori contengono acqua e cationi necessari a bilanciare l’eccesso di carica dell’impalcatura. I cationi sono mobili e possono essere scambiati con altri cationi (tratto da dispense Antonio Liciulli).
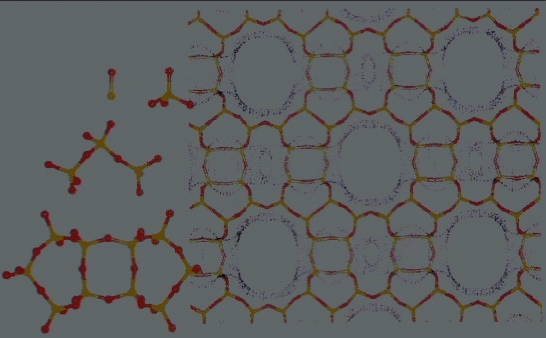
Fig. 2: Struttura delle zeoliti: in rosso atomi di ossigeno e in giallo gli atomi di silicio; in bianco le zone accessibili alle molecole d’acqua (tratto da dispense Antonio Liciulli).
Per ciò che concerne la caolinizzazione dei feldspati (ad esempio il feldspato potassico – KAlSi3O8) si ricorda che il processo è osservabile abbastanza di frequente in natura, specie su rocce granitiche.
E’ una reazione di alterazione, che coinvolge la presenza di acqua e di ioni idrogeno, mediante la quale si ha la trasformazione del feldspato dapprima in mica potassica e successivamente da quest’ultima il passaggio alla caolinite, minerale argilloso dotato di minore resistenza meccanica. Il processo di alterazione può comunque continuare sino ad ottenere come prodotti finali sia l’acido silicico (solubile in acqua) sia la gibbsite (ossido di alluminio idrato). In pratica, da un punto di vista chimico, l’acqua riesce ad asportare gli atomi di potassio e sodio uniti agli atomi di ossigeno attraverso legami ionici; il silicato che perde un atomo di Na o K e lo sostituisce con un ossidrile, genera un nuovo silicato che appunto prende il nome di caolinite.
Bibliografia:
Dispense prof. Antonio Liciulli – scienza e tecnologia dei materiali
Carobbi – Fondamenti di cristallografia e ottica cristallografica
Bonatti Franzini – Cristallografia mineralogica (Boringhieri)
Gottardi – I minerali (Boringhieri)