 |
Ghiaccio: nome delle varie forme cristalline (ne sono note 5) dell’acqua allo stato solido. Il peso specifico è pari a 0,92, inferiore di circa l’8% rispetto a quello dell’acqua. Il ghiaccio è quindi composto da molecole di acqua cristallizzate. |
 |
| Forma | Aghiformi | A piastrina | Dendritici | Forme prismatiche |
Prismi piramidali |
| Immagine |  |
 |
 |
 |
 |
| Temperatura in °C |
sotto i -5 °C | Tra i -10 °C ed i -20 °C |
-15 °C | Tra i -45 °C ed i -50 °C |
Tra i -50 °C ed i -90 °C |
Figura 1. Le cinque forme cristalline dell’acqua che solidifica nel sistema esagonale.
Generalmente, se prendiamo una sostanza solida e la facciamo fondere, il liquido ottenuto ha un volume maggiore di quello del solido.
Viceversa, facendo solidificare quella sostanza liquida, otterremo un solido di volume inferiore a quello del liquido. In altre parole un pezzo di ferro solido occupa un volume minore di quel ferro liquido ottenuto per fusione.
l’acqua solidificando aumenta di volume; ciò è dovuto al fatto che le molecole si dispongono stabilmente in un reticolo di cristalli secondo una struttura geometrica esagonale, nella quale gli spazi fra molecola e molecola sono maggiori di circa l’8,7% rispetto a quelli tra le molecole allo stato liquido.
Quindi, se facessimo ghiacciare un litro d’acqua liquida (1000 cm3 = 1 dm3) otterremmo un blocco di ghiaccio dal volume di circa 1.087 cm3. Tale blocco potrebbe essere un parallelepipedo a base quadrata con lato di 10 cm e con altezza di cm 10,87. Se messo in acqua, tale blocco galleggerebbe emergendo dal livello dell’acqua per circa 9 millimetri.
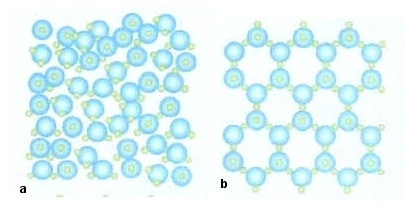 |
(a) allo stato liquido; (b) allo stato solido, cioé ghiaccio.
Quando il ghiaccio fonde (si scioglie) l’impalcatura spaziosa crolla progressivamente, le molecole si avvicinano e diminuisce il volume dell’acqua che ne deriva. L’acqua così ottenuta ha densità maggiore del ghiaccio da cui deriva.
Dalla figura 2 si comprende benissimo che lo stesso numero di molecole d’acqua cristallizzate (ghiaccio) occupa uno spazio maggiore rispetto alle stesse molecole d’acqua liquida.
La particolare disposizione delle molecole cristallizzate è causata dal fatto che durante la cristallizzazione, processo che avviene quando l’acqua solidifica, si ha una diminuzione di energia libera (viene sottratta energia all’acqua).
Il reticolo cristallino che si forma è un sistema in equilibrio che corrisponde ad un contenuto minimo di energia.
In parole povere, le molecole assumono una certa disposizione per “adattarsi” alla diminuzione di energia disponibile per muoversi.
Dunque due volumi uguali, uno contenente acqua allo stato liquido e l’altro acqua allo stato solido, non contengono un ugual numero di molecole; e precisamente:
il primo volume (d’acqua) ne contiene un numero maggiore del secondo (di ghiaccio).
Ne consegue che il peso specifico del ghiaccio è inferiore a quello dell’acqua allo stato liquido.
L’importantissima conseguenza del fatto c
he l’acqua aumenta di volume allo stato solido, è che il ghiaccio ha un peso specifico minore dell’acqua e pertanto galleggia. Inoltre esso è un buon isolante termico e quindi non favorisce il congelamento degli strati d’acqua sottostanti: ciò consente la sopravvivenza di tutti gli organismi che vivono nelle acque.Se il ghiaccio non galleggiasse, si avrebbero delle terribili conseguenze: scenderebbe sul fondo esso, si accumulerebbe estendendosi via via sempre più verso la superficie, fino a rendere gelata l’intera massa degli oceani e dei mari che non potrebbero più ospitare forme di vita al loro interno.
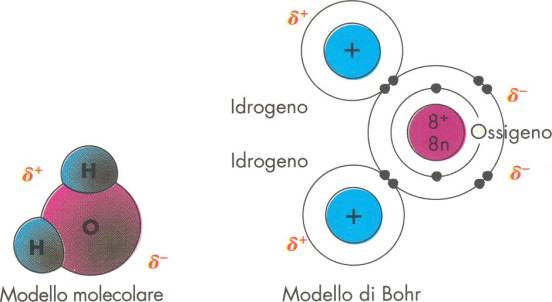
|
Figura 3. La molecola dell’acqua secondo il modello molecolare e il modello di Bohr.
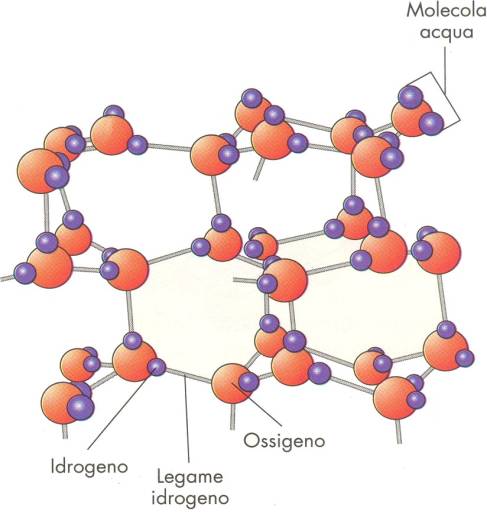 |
Figura 4. Molecole d’acqua liquida.
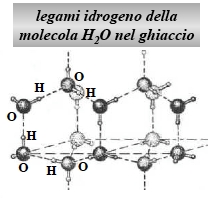 |
Figura 5. Legami idrogeno tra le molecole del ghiaccio.
L’idrogeno ionizzato, con le sue piccole dimensioni fa da “ponte” fra due ioni di ossigeno.
La crescita dei cristalli di ghiaccio è detta RIMING visibile attraverso questa straordinaria riproduzione (figura 6) offerta dal sito www.snowcrystals.com:

Figura 6. Riming