La fiamma è il prodotto di reazioni chimiche esotermiche, cioè che producono calore; il colore e la temperatura di una fiamma dipendono dalla sostanza impiegata nella combustione.
Si veda anche la voce ‘Flame’ (in inglese) su wikipedia.
La reazione di combustione richiede un combustibile ed un comburente che lo ossidi: comunemente il comburente è l’ossigeno, ma si possono produrre combustioni con altre sostanze: per esempio idrogeno in cloro, oppure idrazina in tetrossido d’azoto, sostanze usate nei motori dei missili.
Quando il combustibile reagisce con il comburente, si produce abbastanza calore per far continuare la reazione, portando i reagenti alla soglia di energia necessaria per la prosecuzione (spesso la fiamma va ‘innescata’!). Nel processo si formano vari radicali liberi, molto reattivi, ma possono restare anche aggregazioni di combustibile incombusto. I radicali, ricombinandosi, emettono luce a causa delle eccitazioni elettroniche, mentre le particelle incombuste emettono per radiazione di corpo nero. In tal caso, il colore della luce emessa dipende dalla temperatura raggiunta nella fiamma.
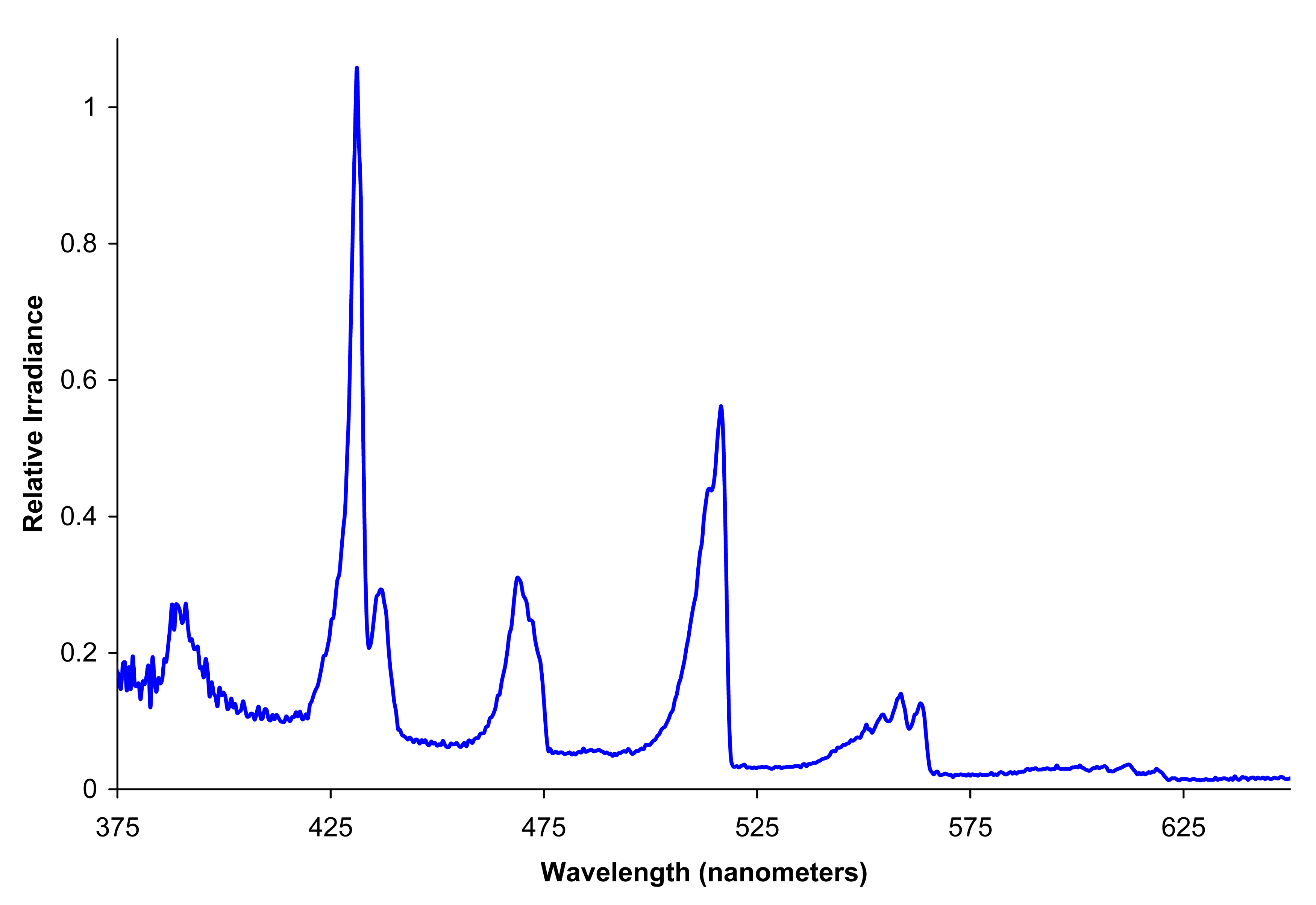
Il colore di una fiamma è quindi dovuto all’emissione di radiazione elettromagnetica da parte di atomi, ioni, molecole e radicali interessati dalla reazione di combustione.
Il colore risultante, come detto, è dato dalla combinazione di due processi separati: le righe di emissione di atomi, molecole, ioni e radicali presenti e le emissioni di corpo nero da parte di eventuali particelle incombuste.
Nelle fiamme più comuni, quelle idrogeno-carbonio, il fattore più importante per la determinazione del colore è la disponibilità di ossigeno e la miscelazione ossigeno-combustibile, che determinano la temperatura e quindi il percorso della reazione.
In questo caso si possono osservare diversi colori a seconda della temperatura di combustione, ed in allora si può risalire alla temperatura della fiamma a partire dal colore delle fiamme; un metodo simile è utilizzato dai pompieri per stimare la temperatura all’interno di un fuoco osservando il colore delle fiamme prodotte. In generale, la parte più fredda di una fiamma a combustione incompleta è dunque rossa, per passare via via all’arancione, al giallo e al bianco-azzurrino. Una fiamma completamente blu deriva esclusivamente dalle regioni in cui la combustione (del carbonio) è completa e quindi l’emissione di righe domina sull’emissione di corpo nero.
|
Colore fiamma |
Temperatura in °C |
|
Amaranto pallido |
480
|
|
Amaranto
|
525
|
|
Rosso sangue |
585
|
|
Rosso scuro |
635
|
|
Rosso
|
675
|
|
Rosso chiaro |
740
|
|
Rosso pallido |
845
|
|
Rosa
|
900
|
|
Arancione
|
940
|
|
Giallo
|
995
|
|
Giallo pallido |
1080
|
|
Bianco
|
1205
|
|
Azzurro
|
1400
|
Oltre a ciò, c’è da considerare che sostanze diverse inserite nella fiamma producono colori differenti: ad esempio il sodio genera luce gialla (dovuta all’emissione delle righe D dello spettro, a circa 590 nm), il potassio genera luce violetta, il litio luce rossa, il rame verde.
La conoscenza di queste proprietà permette il riconoscimento di specie chimiche dall’analisi del colore sulla fiamma (analisi alla fiamma), una tecnica molto comune nell’analisi chimica qualitativa.