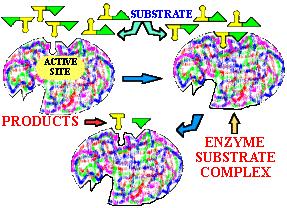
Gli enzimi sono catalizzatori, proteine che aumentano la velocità delle reazioni cellulari. Sono classificati a seconda del tipo di reazione che catalizzano: ossidoridutasi, idrolasi, trasferasi, lisasi, isomerasi, ligasi. La reazione avviene in un sito dell’enzima, detto sito attivo.
Da: http://www.slic2.wsu.edu:82/hurlbert/micro101/images/metab25.gif
Per una descrizione completa delle proprietà degli enzimi, oltre ad un testo di biochimica, puoi vedere i seguenti siti.
In italiano http://www-biol.paisley.ac.uk/KINETICS/italiano/benvenuto.html .
In inglese: http://en.wikipedia.org/wiki/Enzyme
Un’altra suddivisione considera invece un certo numero di caratteristiche tra cui la cinetica di reazione e divide gli enizmi in allosterici e non allosterici.
Una cosa che tutte le proteine ed enzimi allosterici hanno in comune è il fatto di possedere una struttura polimerica o quaternaria. Vale a dire che una proteina allosterica completa consisterà di un numero di catene proteiche separate chiamate subunità, legate l’un l’altro da interazioni deboli come legami ad idrogeno e ponti idrofobici.
Gli enzimi allosterici cambiano la loro struttura come risposta a delle molecole “regolatrici”. La molecola regolatrice, detta effettore, può far aumentare o diminuire l’attività dell’enzima. Nel primo caso si parla di attivatore nel secondo di inibitore. Così in un enzima allosterico il legarsi di una molecola di substrato ad un sito attivo dà inizio ad un cambio di conformazione che aumenta la capacità degli altri siti attivi di legare il substrato. Dal momento che le subunità sono legate tra loro mediante legami deboli si possono facilmente distaccare e riattaccare. Perciò l’enzima si troverà spesso in soluzione come un equilibrio tra l’enzima completo e le sue subunità individuali.
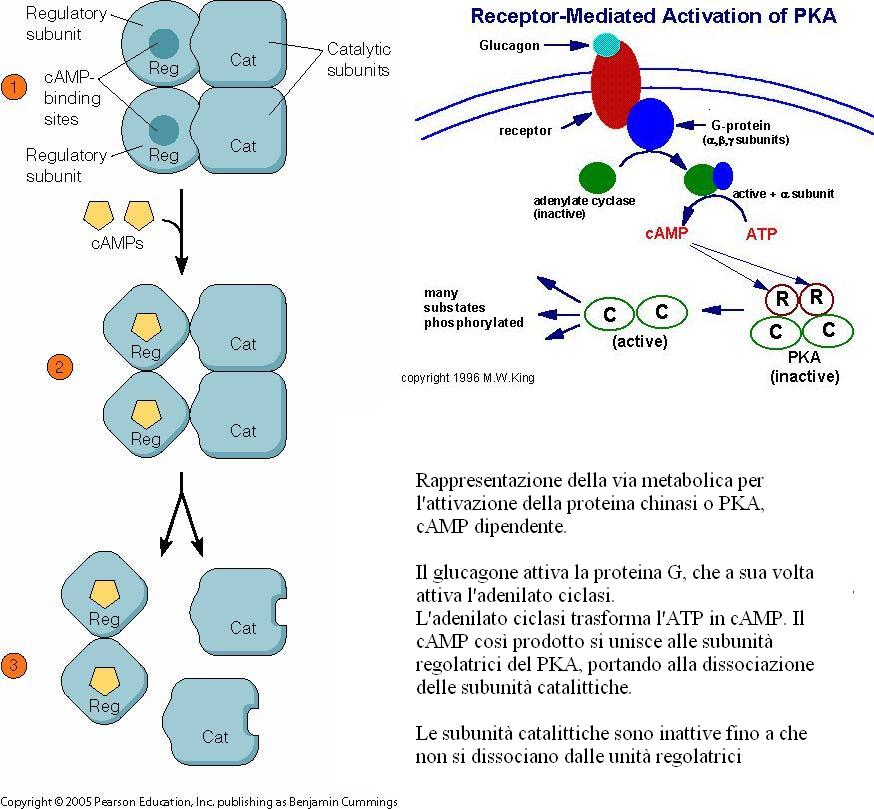
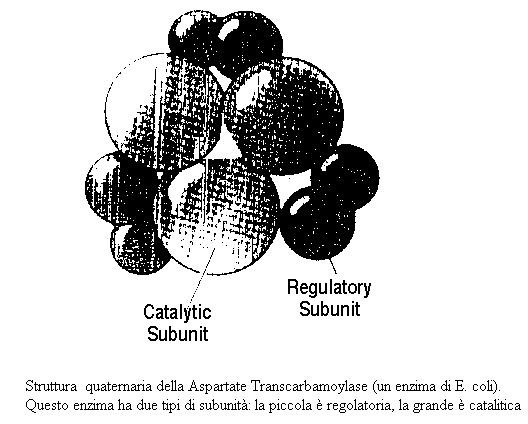
Per rispondere alla domanda, allego due illustrazioni che si riferiscono agli enzimi allosterici PKA o proteina chinasi e il CTP o aspartatotranscarbamilasi, da cui si deduce che esistono anche enzimi allosterici, che hanno subunità con funzioni differenti.
PKA o proteina chinasi.
http://www.mun.ca/biology/desmid/brian/BIOL2060/BIOL2060-14/1408.jpg
e http://www.med.unibs.it/~marchesi/pkacamp.html
CTP o aspartatotranscarbamilasi : http://www-biol.paisley.ac.uk/KINETICS/italiano/capitolo5.htm