La reazione di solubilizzazione dello zucchero in acqua, facilmente realizzabile ed osservabile da chiunque, prevede l’utilizzo dell’acqua come solvente e dello zucchero come soluto.
A seconda della quantità di zucchero utilizzata, la soluzione risultante avrà diverse concentrazioni, fino alla saturazione, nel quale parte dello zucchero non viene più sciolto e si accumula sul fondo in forma solida.
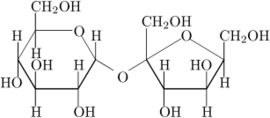
Generalmente con il termine zucchero siamo soliti indicare il saccarosio, comune zucchero da cucina, il quale è un dimero (glucosio + fruttosio) caratterizzato dalla presenza di domini polari –OH.
Lo zucchero, come tutti i carboidrati, a temperatura ambiente ha una forma solida cristallina mantenuta da legami H tra i dimeri di saccarosio; per rompere questi legami è necessaria energia (principalmente cinetica).
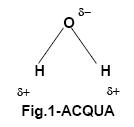
L’acqua è un solvente polare, formata da dipoli interagenti con legami H.
Fra le sue tante proprietà vi è quella di sciogliere sostanze dotate di gruppi ionici o polari come –COO- , -NH3 , -S-, N2, -CO e OH.
Quando lo zucchero viene immesso nel solvente, le molecole d’acqua tendono ad interagire ed a formare legami H con i gruppi –OH- della molecola di zucchero (vedi figura).
I nuovi legami H che si formano tra le molecole del solvente con quelle del soluto sono molto più forti e stabili di quelli originari, l’energia totale del sistema diminuisce e il processo quindi avviene spontaneamente perché termodinamicamente favorito.
.jpg)
In grigio le molecole di zucchero, in blu le molecole d’acqua.
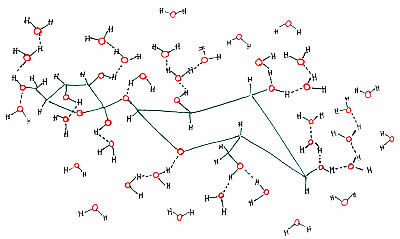
Gli zuccheri sono quindi molto solubili in acqua, moderatamente solubili negli alcoli e per nulla solubili in solventi non polari come l’etere etilico, il cloroformio ed il benzene formati da molecole neutre senza domini polari che non possono quindi formare legami H.
La solubilizzazione dello zucchero in acqua provoca inoltre dei cambiamenti nelle proprietà nel solvente, come ad esempio l’abbassamento crioscopico (vedi approfondimenti).
Per approfondimenti: