La scrittura delle formule di Lewis fa uso di una notazione in cui gli elettroni del guscio di valenza di ogni atomo vengono rappresentati da punti posti intorno al simbolo chimico dell’elemento stesso.
Gli elementi chimici si comportano secondo la regola dell’ottetto secondo la quale un atomo forma legami mettendo in comune un numero di elettroni tale da realizzare attorno a sé un “ottetto” di elettroni, in altre parole ogni atomo formerà tanti legami covalenti con altri atomi, quanti sono gli elettroni necessari per raggiungere la configurazione del gas nobile più vicino.
Naturalmente non tutti gli elettroni di un atomo contribuiranno nel legame covalente, gli elettroni appartenenti ai livelli energetici inferiori formeranno coppie di elettroni non condivise.
Nelle strutture di Lewis, i legami covalenti formati dalla condivisione degli elettroni vengono rappresentate con una lineetta che unisce i due atomi, essa rappresenta perciò una coppia di elettroni.
Facciamo un esempio: consideriamo il composto formato da un atomo di Idrogeno (H) e da un atomo di iodio ( I ). Questi due elementi hanno rispettivamente nel guscio elettronico più esterno, un elettrone e 7 elettroni in grado di poter essere condivisi. Secondo la regola dell’ottetto l’atomo di iodio per raggiungere la configurazione stabile dell’elemento nobile più vicino, ovvero lo xeno, deve acquistare un elettrone. L’idrogeno a sua volta per raggiungere un livello energetico stabile, uguale al gas nobile a lui più vicino, ovvero l’elio deve condividere il suo elettrone.
I due atomi perciò condivideranno gli elettroni dei livelli energetici più esterni formando un legame rappresentabile secondo la struttura di lewis nel seguente modo:
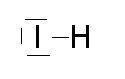
Nel caso dell’ossigeno però la formazione di un legame singolo non porta al completamento dell’ottetto sui due atomi, tuttavia la configurazione elettronica del gas nobile può ancora essere realizzata se si mettono in comune tutti i rimanenti elettroni solitari (elettroni spaiati) presenti nei due atomi. Si forma così un legame doppio, o nel caso dell’azoto un legame triplo.
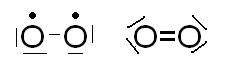
Talvolta però, vi sono importanti eccezioni in cui elementi del secondo periodo formano composti nei quali la regola dell’ottetto è violata. Specie chimiche di questo tipo possono accettare una coppia di elettroni da altre che possiedono doppietti elettronici solitari ed energeticamente accessibili producendo così un tipo di legame detto “Dativo” in cui vengono impegnati due elettroni di uno stesso atomo.
La regola dell’ottetto inoltre, non è vincolante nel caso di elementi appartenenti a periodi successivi al secondo, dove talvolta si arrivano a contare attorno agli atomi anche 12 o più elettroni. Questi elementi possono ospitare nel loro intorno più di otto elettroni perché dispongono di orbitali d vuoti dello stesso numero quantico principale degli orbitali s e p del guscio di valenza.
Quindi , generalmente per determinare una struttura di lewis di un qualsiasi composto chimico si procede come segue:
1) calcolare il numero globale degli elettroni da sistemare
2) disporre i singoli atomi come determinato dalla formula della sostanza
3) usare gli elettroni spaiati per completare gli ottetti
4) convertire le coppie di elettroni solitarie in coppie di legame se qualche atomo rimane con l’ottetto incompleto
Nel caso di elementi successivi al secondo periodo, come per lo iodio ( I ), bisogna necessariamente tenere presente che la regola dell’ottetto non è vincolante, ed è perciò possibile convertire altre coppie di elettroni solitarie in coppie di legame per neutralizzare le cariche formali.