La molecola d'acqua, come ben noto, è composta da un atomo di ossigeno e da due atomi di idrogeno che formano tra loro un angolo di 104,45° e che sono distanti dall'atomo di ossigeno 0,9584 A come illustrato nella figura seguente:
_svg.png)
Non esistono in natura, né sono costruibili artificialmente, molecole H2O con una disposizione diversa degli atomi, poiché, in generale, una molecola specifica ha una sua geometria specifica.
Per parlare della natura di una molecola occorre partire dalla natura di un atomo: questo ha una determinata configurazione elettronica e gli elettroni alla base dei legami chimici sono quelli di valenza, che si trovano nel guscio più esterno. La teoria VSEPR (acronimo dall'inglese Valence Shell Electron Pair Repulsion), ci dice che le coppie elettroniche nel guscio di valenza tendono a disporsi il più lontano possibile fra loro. Ciò è in accordo con la legge di Coulomb, secondo la quale le cariche elettriche di segno uguale si respingono.
E’ logico aspettarsi quindi che due atomi per legarsi si dovranno avvicinare con un’orientazione opportuna. Se poniamo l’attenzione su un atomo che funge da centro e che è legato ad un certo numero di atomi, possiamo immaginare che la distribuzione dei legami attorno ad esso verrà a dipendere dal numero totale di coppie di elettroni che lo circondano, sia quelle che sono coinvolte in legami chimici sia quelle che non sono coinvolte in nessun legame chimico (dette coppie solitarie).
Sulla base di semplici considerazioni geometriche si può dimostrare la seguente corrispondenza:

La geometria molecolare vera e propria si riferisce alle posizioni degli atomi e non delle coppie solitarie. Essa è quindi determinata direttamente solo dalla disposizione delle coppie leganti in quanto solo a queste corrisponde un atomo legato all’atomo centrale.Tuttavia la presenza di coppie solitarie altera la disposizione delle coppie leganti e pertanto influenza indirettamente la geometria molecolare.
L’atomo di ossigeno presenta due coppie di legame e due coppie solitarie: le coppie di legame si legheranno agli atomi di idrogeno, quelle solitarie si disporranno in maniera da minimizzare le forze repulsive. E’ la loro presenza che fa sì che l’angolo di legame sia minore di 109,5 ° (relativa alla geometria tetraedrica, propria ad esempio della molecola del metano) ed esattamente 104,45 °.
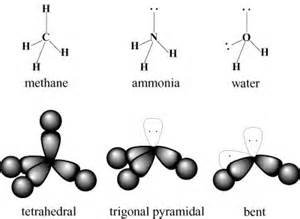
Inoltre, non è chimicamente possibile legare l’atomo di ossigeno e i due atomi di idrogeno in maniera diversa, ad esempio legando gli idrogeni tra loro, principalmente perché ogni idrogeno ha un elettrone disponibile per creare un legame, quindi non lo può condividere con due atomi.