La velocità di una reazione è riferita al tempo in cui i reagenti si trasformano nei prodotti nel processo che porta il sistema al raggiungimento del suo stato d’equilibrio.
Data una reazione generica aA+bB <=> cC+dD la sua velocità ad un certo tempo t, espressa indifferentemente dalla derivata della concentrazione rispetto al tempo di uno qualunque dei reagenti e prodotti, è:
Vreaz = -(1/a)*(d[A]/dt) = -(1/b)*(d[B]/dt) = -(1/c)*(d[C]/dt) = -(1/d)*(d[D]/dt)
In generale la velocità iniziale (vreaz) di una reazione dipende dalla temperatura del sistema e dalla concentrazione dei reagenti:
Vreaz = f(T,CM)
Data una reazione generale aA+bB<=>cC che avviene in un contenitore di reazione mantenuto a T costante, la dipendenza della sua velocità dalle concentrazioni dei reagenti è espressa dall’equazione
Vreaz = k[A]x [B]y
chiamata usualmente Legge cinetica della reazione. La velocità di una reazione è quindi proporzionale al prodotto della concentrazioni molari dei reagenti, ciascuna delle quali è elevata ad una potenza x e y.
La velocità di reazione può essere dipendente anche dalla concentrazione dei prodotti finali; tuttavia all’inizio della reazione le concentrazioni dei reagenti sono molto maggiori di quelle dei prodotti che così non influenzano in modo apprezzabile la velocità di reazione.
I valori delle costanti k, x e y devono essere determinati sperimentalmente per ogni reazione. La costante k è la costante cinetica o velocità specifica della reazione e rappresenta la velocità iniziale ad una data temperatura (generalmente 298 K) quano le concentrazioni dei reagenti sono 1M. In letteratura si trovano molte tabelle dove sono riportate le k di moltissime reazioni.
.png)
Fig. 1 – Esempio di determinazione sperimentale della velocità di una reazione al variare della temperatura [S]. In rosso sono indicati i punti sperimentali, mentre in blu è indicata la curva di regressione.
Le costanti x e y sono invece l’ordine della reazione rispetto al componente A e B. La somma x+y rappresente l’ordine complessivo della reazione ed esso può essere un numero intero o frazionario. Notiamo bene che x e y non coincidono necessariamente con i coefficenti stechiometrici a e b della reazione stessa e quindi non possono essere ricavate o dedotte direttamente; possono essere però ricavate sperimentalmente per ciascuna reazione.
Ad esempio, l’espressione della legge cinetica della reazione H2+I2<=>2HI è la seguente:
v= -(d[H2]/dt) = k[H2][I2]
In questo esempio è stata scelta una reazione in cui l’ordine coincide con i coefficenti stechiometrici e l’ordine complessivo è 2. Nella seguente reazione invece le cose cambiano:
H2+Br2<=>2HBr e quindi v= -(d[H2]/dt) = k[H2][Br2]1/2
In questo caso l’ordine rispetto ad H2 coincide con il coefficente stechiometrico, mentre quello rispetto a Br2 è diverso. L’ordine complessivo è 3/2.
Per comprendere il motivo per cui reazioni appartemente identiche abbiano valori diversi per x e y bisogna considerare che questi dipendono dal meccanismo di reazione, che non è in generale evidente dall’equazione stechiometrica. La determinazione sperimentale di grandezze come x e y porta poi alla formulazione di modelli di meccanismo che devono essere consistenti con la cinetica osservata.
I risultati sperimentali della legge cinetica delle reazioni in fase gassosa possono essere riprodotti con sufficiente approssimazione sulla base di un modello di meccanismo di reazione basato sull’assunzione che due specie per reagire e per dar luogo ad un prodotto di reazione debbano collidere fra loro. Questa è condizione necessaria ma non sufficiente. Di tutte le possibili collisioni, il cui numero può essere calcolato in base alla teoria cinetica dci gas, solo una frazione molto piccola porta effettivamente ad una reazione (urti efficaci); la maggior parte delle collisioni sono infatti inefficaci a dar luogo ad una reazione. Affinché la collisione possa dar luogo ad un prodotto è necessario che le particelle collidenti possiedano un’energia maggiore di un valore minimo o soglia minima, Ea. Questa soglia di energia è chiamata energia di attivazione; il suo significato può essere meglio compreso mediante l’esempio della reazione, già vista, fra H2 ed I2
H2+I2<=>2HI
Ammettendo che la reazione avvenga a temperatura costante, l’energia dei reagenti e dei prodotti è l’energia potenziale di legame nelle molecole H2, I2 ed Hl, più l’energia cinetica che, tuttavia, rimane costante durante tutto il processo. Si immagini ora di avvicinare le due molecole H2 ed I2 orientate secondo questo modo
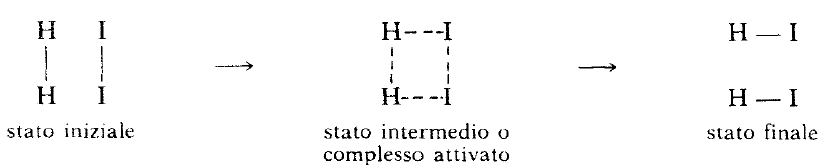
Fig 2
e di calcolare la variazione dell’energia potenziale in funzione della distanza fra le particelle interagenti. Dapprima si ha una piccola diminuzione di energia potenziale a causa della formazione di deboli legami di Van der Waals; avvicinando ancora di più le molecole, l’energia potenziale aumenta drasticamente fino a raggiungere un valore massimo in corrispondenza della formazione dello stato intermedio della reazione in cui i legami H-H e I- I si sono indeboliti rispetto a quelli delle molecole isolate mentre si sono formati deboli legami H- l. A questo punto tutte le distanze di legame hanno valori comparabili ed al sistema formato si dà il nome di complesso attivato. Poiché sia i prodotti di reazione che i reagenti hanno energia minore di quella del complesso attivato, lo stadio successivo della reazione può essere sia l’allontanamento di atomi uguali con conseguente avvicinamento di H ad I e la
formazione dei prodotti di reazione, sia la formazione di nuovo dei reagenti. La variazione dell’energia potenziale delle specie che prendono parte alla reazione può essere riportata in un diagramma in funzione delle distanze interatomiche (nel caso dell’esempio precedente H- H e H- (oppure I- I ed H- I), funzione che è chiamata coordinata di reazione, come si può vedere in figura
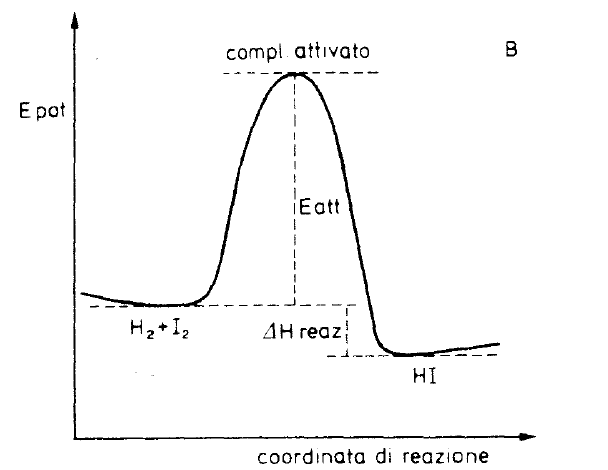
Fig. 3 – Variazione dell’energia potenziale per una reazione esotermica in funzione della coordinata di reazione. In questo esempio la variazione di energia potenziale coincide con la variazione di entalpia poiché la trasformazione è isoterma e non comporta variazione del numero di molecole.
La differenza di energia fra lo stato attivato e lo stato normale delle molecole reagenti è l’energia di attivazione; la differenza di energia potenziale (essendo l’energia cinetica costante poiché si è assunto che la temperatura sia mantenuta costante durante la reazione) fra lo stato iniziale e quello finale è la variazione di entalpia della reazione poiché non si ha variazione del numero di particelle e conseguentemente non si ha neppure lavoro meccanico nella trasformazione.
Appare ora chiara la ragione per la quale non tutte le collisioni portano ad una reazione, ma soltanto quelle che coinvolgono particelle che hanno energia cinetica, Ecin maggiore dell’energia di attivazione, Ea. Se si prendesse in esame la curva di distribuzione della Ecin in un gas, noteremmo che deve esistere una frazione di particelle, che aumenta all’aumentare della temperatura, che ha Ecin > Ea: sono queste le particelle che, se collidono, danno luogo ad uno stadio della reazione e quindi determinano la velocità di quello stadio della reazione. Inoltre la frazione di molecole che hanno energia maggiore dell’energia di attivazione dipende dal valore di quest’ultima,
ad una data temperatura. Quanto maggiore è l’energia di attivazione tanto minore è la frazione di particelle che hanno energia maggiore di essa.
La velocità di una reazione aumenta all’aumentare della temperatura, perché aumenta il numero di particelle che hanno energia maggiore di quella di attivazione, ed al diminuire dell’energia di attivazione a temperatura costante. L’energia di attivazione di una reazione dipende, infine, dal percorso seguito dai reagenti per trasformarsi nei prodotti. L’energia di attivazione riportata nella figura precedente si riferisce al percorso più favorevole che il sistema segue e che è rappresentato dall’urto fra due molecole orientate reciprocamente nel modo schematizzato precedentemente. Una collisione fra molecole orientate in maniera diversa comporta una maggiore energia di attivazione e costituisce quindi un percorso meno favorevole per la reazione ed è quindi seguito da un minor numero di particelle.
La reazione inversa di decomposizione di Hl segue lo stesso percorso della reazione diretta e possiede lo stesso complesso attivato: l’energia di attivazione è invece maggiore di quella della reazione diretta poiché
l’energia del sistema costituito da molecole Hl è minore rispetto a quella posseduta da H2 ed I2.
Per concludere, la velocità di una qualunque reazione dipende dalle concentrazioni dei reagenti e dalla temperatura, per confrontare utilmente velocità di reazione diverse si fa riferimento alla costante di velocità k o velocità specifica della reazione ad una data temperatura. Essa è una caratteristica di ciascuna reazione per ogni temperatura, come lo è Keq da un punto di vista termodinamico, ed è legata al meccanismo con cui la reazione avviene. Se la costante k non fosse costante non sarebbe chiamata costante ma variabile dipendente.
Fig. 4 – Effetti dell’aumento della concentrazione nelle reazioni chimiche.
———————————————————–
Bibliografia
(1) Ivano Bertini – Fabrizio Mani – Lezioni di Chimica II Edizione – Edizioni Cedam Padova
(2) Ivano Bertini – Fabrizio Mani – Stechiometria, un’avvio allo studio della chimica – Edizioni Cedam Padova
(3) Ivano Bertini – Claudio Luchinat – Fabrizio Mani – Chimica – Edizioni Cedam Padova
Le immagini sono tratte da: (1): Fig. 2 e 3 e Wikipedia: fig. 1 e 4