I livelli di organizzazione delle proteine sono quattro:
1)struttura primaria, la semplice sequenza di amminoacidi;
2)secondaria, la combinazione di pochi amminoacidi a dare strutture tenute insieme da legami idrogeno con valori costanti degli angoli intorno al carbonio chinale (Cα), φ (Cα-NH) e ψ (Cα-CO);
3)terziaria, la disposizione tridimensionale degli elementi di struttura secondaria della proteina;
4)quaternaria, la combinazione delle strutture tridimensionale di due o più proteine diverse a dare un unico agglomerato, detto genericamente multimero, di cui le singole proteine sono le subunità.
La funzione di una proteina è determinata dalla struttura terziaria, la quale a sua volta dipende esclusivamente dalla sequenza amminoacidica. Questo è stato dimostrato da numerosi esperimenti di denaturazione e rinaturazione di proteine. La denaturazione è la perdita della struttura tridimensionale della proteina, dovuta ad agenti come il calore, pH estremi o reagenti chimici; comporta conseguentemente la perdita della funzione della proteina, ma non è irreversibile, infatti alcune proteine denaturate possono riacquistare struttura e funzione se vengono riportate nelle condizioni in cui la conformazione nativa è stabile. Tale processo è detto rinaturazione.
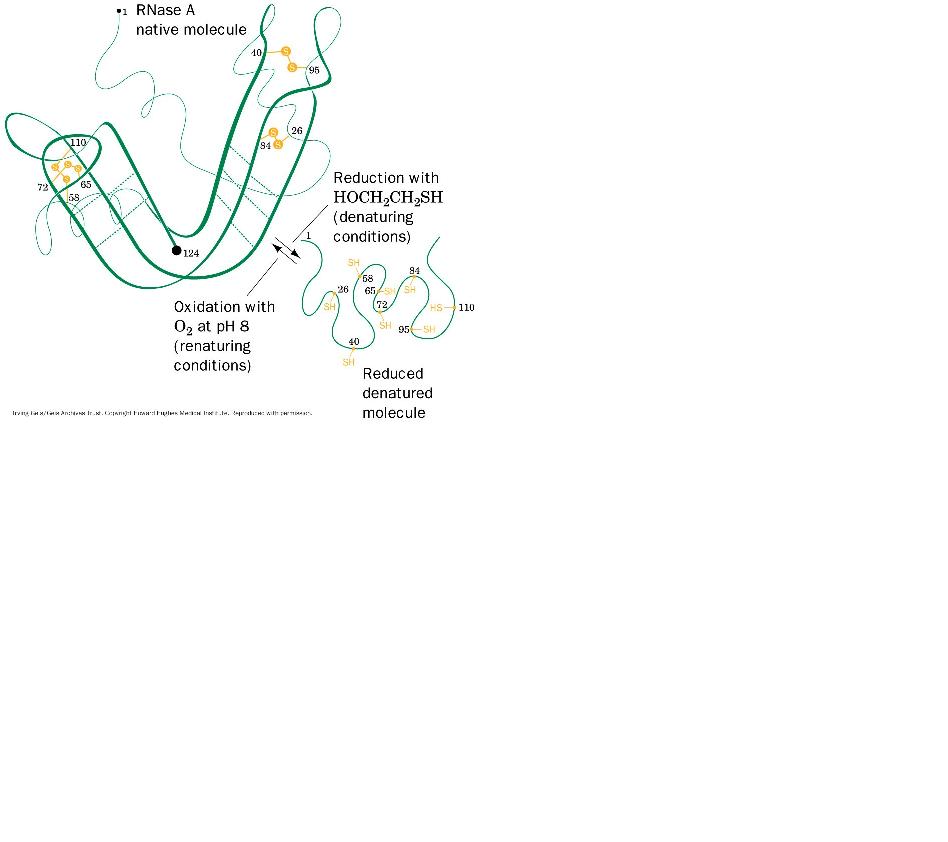
Un esempio molto significativo di denaturazione e rinaturazione è appunto l’esperimento messo a punto negli anni Cinquanta dal biochimico americano Christian Anfinsen con la ribonucleasi A. La ribonucleasi A è un enzima secreto dal pancreas che idrolizza alcuni acidi ribonucleici ingeriti con la dieta; può essere denaturata con una soluzione concentrata di urea in presenza di un agente riducente (β-mercaptoetanolo): quest’ultimo rompe i quattro ponti disolfuro generando otto residui di cisteina (Cys), invece l’urea scinde le interazioni idrofobiche, liberando così la catena polipeptidica dalle interazioni che ne mantengono la conformazione. La denaturazione è accompagnata da una perdita completa dell’attività catalitica. Riportando l’enzima in condizioni ossidanti ed eliminando l’urea in modo rapido si ottiene un recupero solo dell’1% rispetto all’attività catalitica iniziale, mentre facendo la stessa cosa più lentamente (7-8 ore) si ha un recupero vicino al 100%. Il motivo di questa differenza è che la proteina ha il tempo di riassumere la sua conformazione nativa perciò recupera di conseguenza anche l’attività. Il riavvolgimento è così accurato che i quattro ponti disolfuro si riformano nella proteina in fase di rinaturazione nelle stesse posizioni iniziali, nonostante – è stato calcolato – la possibilità che ciò avvenga sia 1/105. Altre prove, fatte con ribonucleasi di sintesi chimica e non purificata, hanno confermato i risultati ottenuti, escludendo la possibilità di una contaminazione nella preparazione usata da Anfinsen. Sulla base di questi risultati lo scienziato elaborò la cosiddetta “ipotesi termodinamica”:
1) la conformazione tridimensionale di una proteina è determinata solo dalla sua sequenza amminoacidica;
2) essendo il ripiegamento spontaneo, lo stato nativo corrisponde alla struttura cui è associata l’energia minore (minimo assoluto). Le proteine e le molecole non sono statiche e possono assumere diverse conformazioni cui sono associate differenti energie conformazionali, ma è più probabile che si trovino in una conformazione ad energia bassa piuttosto che alta perché minore è l’energia necessaria per disporsi in questo modo. In termodinamica la spontaneità di una reazione è tanto maggiore quanto minore è l’energia dello stato finale rispetto a quello iniziale, perciò è ragionevole pensare che lo stato nativo corrisponda al minimo energetico, visto che il folding di una proteina avviene spontaneamente sempre in un certo modo e a dare sempre il medesimo risultato, cioè la conformazione nativa.
Fonti:
Nelson, Cox, "I principi di biochimica di Lehninger", Zanichelli
D.Voet, J.Voet, "Fondamenti di biochimica", Zanichelli
Copyright della fondazione Irwin Geis: