Il sito attivo di un enzima è il punto in cui il substrato viene legato e poi modificato. Inutile qui ripetere delle generalità sugli enzimi, che si possono trovare in molte risposte precedenti sull’argomento:
http://www.vialattea.net/esperti/php/risposta.php?num=2166
http://www.vialattea.net/esperti/php/risposta.php?num=10919
http://it.wikipedia.org/wiki/Enzima
Passando a quella che è la domanda specifica, mentre in genere in letteratura si parla di sito attivo, in alcuni testi, più in linea teorica che altro, si dice che il sito attivo è diviso in due zone: sito di legame e sito catalitico. Individuando nel sito attivo due parti, che collaborano in maniera diversa all’azione dell’enzima.
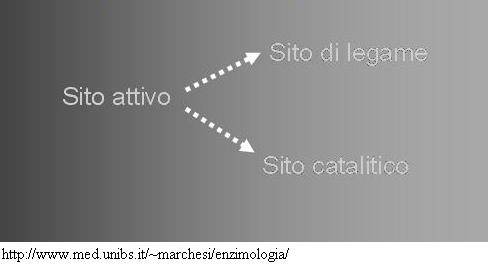
Da: http://www.ddl.unimi.it/tesi/Tesi_BioDock/sper2.htm
“L’acetilcolinesterasi è un enzima omodimerico caratterizzato dalla presenza di un sito di legame per la testa cationica dell’acetilcolina e di un sito catalitico dal quale viene catalizzata l’idrolisi. Quest’ultimo è composto dalla cosiddetta triade catalitica (his440, ser200, glu327) che, prima dell’interazione col substrato, vede la formazione di un legame d’idrogeno fra un’azoto imidazolico dell’istidina e l’idrogeno della serina. Tale interazione polarizza il legame idrogeno – ossigeno (Fig. 4) della stessa serina al fine di rendere l’atomo d’ossigeno più suscettibile a formare un legame con il carbonio carbonilico dell’acetilcolina e a cedere l’idrogeno. Con un meccanismo concertato della durata approssimativa di 150 microsecondi [79], l’idrogeno della serina viene ceduto all’ossigeno della colina con contemporanea rottura del legame estereo colina – acetato e formazione del legame acetato – serina. Successivamente, interviene l’acqua che, grazie alle sue prorietà nucleofile, idrolizza il legame acetato – serina, riportando l’enzima alla situazione di partenza e liberando una molecola di acido acetico. Il rilascio della colina dal sito di legame avviene per riduzione dell’affinità con l’enzima e per spiazzamento da parte di un’altra molecola di substrato.”
Fig 1 Sito attivo dell’enzima acetilcoliesterasi: il sito catalitico è la parte destra.
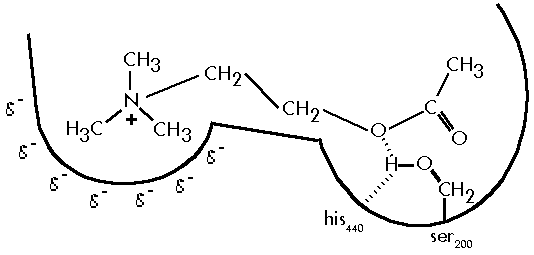
L’enzima aceticolinesterasi
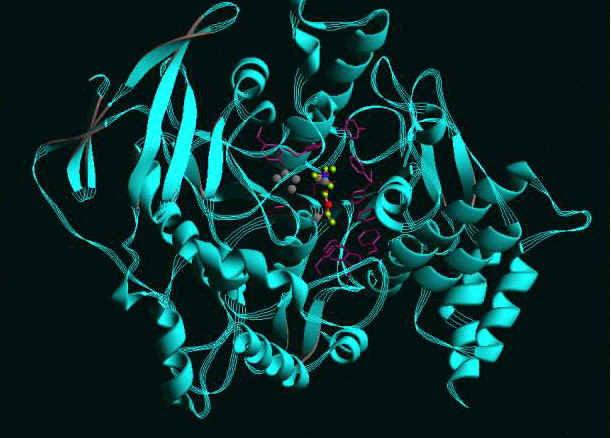
Questa è l’immagine della acetilcolinesterasi, enzima critico per le funzioni nervose in tutti i mammiferi. Questo enzima può venire inibito dai gas nervini e causare la morte. Viene mostrato un inibitore all’interno del sito attivo.
Le strisce rappresentano le sequenze di aminoacidi in struttura a foglietto β, mentre le spirali ne rappresentano la struttura ad α-elica.
http://www.minerva.unito.it/SIS/prioni/proteine.html
Struttura secondaria delle catene polipeptidiche: interessa tratti più o meno lunghi della catena polipeptidica. La catena polipeptidica assume nello spazio una disposizione regolare e ripetitiva. Questa disposizione regolare e ripetitiva è stabilizzata da legami …H… tra il gruppo –NH- di un legame peptidico e il gruppo –CO- di un altro.
Le due principali strutture secondarie sono l’α-elica e la struttura a foglietto β.

Nella struttura ad α-elica i gruppi NH e CO di un segmento polipeptidico formano legami idrogeno originando un giro destrorso di circa quattro amminoacidi.
Nel foglietto β diversi segmenti della catena polipeptidica,che hanno una disposizione distesa sono paralleli tra loro. La struttura è stabilizzata da legami idrogeno tra i gruppi NH e CO di segmenti adiacenti. L’affiancamento di diversi segmenti della catena polipeptidica dà origine a strutture indicate con il termine di foglietti β ( β sheet) ondulati a causa degli angoli di legame.