10.04.2001
Se hai altre
curiosita'

formula qui
la tua domanda
Piero chiede:
Perché acqua ed olio sono tra loro immiscibili? Esiste una tabella di sostanze immiscibili tra loro?
(risponde Nicola Buratti)
La causa dell’immiscibilità tra acqua ed olio è da ricercarsi nel tipo di interazioni che si instaurano tra le due sostanze, intendendo per “interazioni” le forze attrattive o repulsive che si formano quando molecole di una stessa sostanza o di sostanze differenti si avvicinano tra loro.
La forza agente tra due o più molecole è la sovrapposizione di tre tipi di forze:
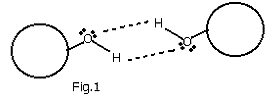
1. Legame idrogeno: è un tipo molto forte di interazione dipolo-dipolo e si instaura quando un atomo di idrogeno è legato chimicamente ad un atomo molto elettronegativo in una molecola; si sviluppa una frazione di carica positiva sull'idrogeno che diviene altamente polarizzato (+) ed una frazione negativa sull'altro atomo (-). Inoltre è necessario che sul secondo atomo sia presente almeno una coppia di elettroni di non legame. Quando una seconda molecola si avvicina, si orienta in modo da esporre la propria coppia di elettroni liberi verso l'idrogeno [Fig.1] ed in questo modo si genera una grande forza di attrazione elettrostatica. Tipici atomi molto elettronegativi sono Ossigeno, Cloro, Azoto, Bromo. Il legame idrogeno è la più forte delle interazioni tra molecole in termini di energia. L 'intensità della forza dipende dall'atomo legato all'idrogeno e dalla coppia di elettroni libera.
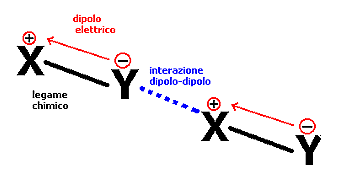
2. Interazione dipolo-dipolo: quando due atomi generici differenti (X, Y) sono legati chimicamente, a causa della loro differente capacità di attrarre gli elettroni, si instaura tra loro una differenza di posizione tra il baricentro delle cariche positive (+) e negative (-) generando un dipolo elettrico [Fig.2] e la molecola si dice polare. Ora due dipoli elettrici vicini tendono ad orientarsi in modo che il baricentro del primo dipolo (+) sia vicino a quello (-) del secondo dipolo e ad attrarsi elettrostaticamente. L'effetto è simile al precedente, difatti il legame idrogeno non è che un tipo particolare di interazione dipolo-dipolo, ma in questo caso l'attrazione non è potenziata dalla presenza di elettroni liberi. Dopo il legame idrogeno, le interazioni dipolo sono le forze di attrazione intermolecolare maggiori. La loro intensità dipende dall'intensità del dipolo elettrico.
3. Forze di van dee Waals: sono forze di energia inferiore rispetto alle precedenti: si dividono in:
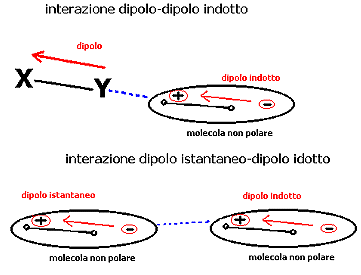
A: dipolo-dipolo indotto: quando una molecola polare si avvicina ad una non polare induce in quest'ultima un dipolo eletrico di minore intensità che perdura fintanto che le due molecole restano vicine. Si genera così attrazione come per il dipolo-dipolo [Fig.3]. L'intensità è proporzionale al dipolo che induce polarizzazione e dalla polarizzabilità della seconda molecola, grandezza che a sua volta cresce con la superfice della molecola.
B: dipolo istantaneo-dipolo indotto: sono dette forze di dispersione di London, dal nome del fisico che le ha studiate. Gli elettroni che si muovno continuamente attorno ad un nucleo creano piccolissimi dipoli istantanei che inducono a loro volta dipoli istantanei su molecole vicine. Queste forze sono debolissime, ma la loro somma genera una risultante che tiene assieme molecole non polari. Sono proporzionali alla superfice delle molecole interagenti.
Il lettore avrà notato come le interazioni che si originano a livello molecolare siano prevalentemente di tipo elettrostatico. Difatti le interazioni gravitazionali al livello di singole molecole sono troppo ridotte per avere un effetto preponderante, mentre le distanze in gioco (dell'ordine di 10-10 metri) sono troppo grandi perché agiscano le forze nucleari.
Veniamo ora al caso particolare di acqua ed olio.
La regola generale pratica e molto utile che viene insegnata agli studenti di chimica è che "il simile scioglie il simile" facendo riferimento al tipo di sostanza ed al tipo di interazioni. Così molecole dotate principalmente di legami idrogeno si scioglieranno bene in sostanze tenute assieme pure da legami idrogeno e così vale per gli altri due tipi di interazioni, vicecersa interazioni differenti tenderanno ad escludersi vicendevolmente.
Nell'acqua prevalgono le forze di tipo legami idrogeno come per il metanolo, l'acido acetico (aceto) e l'alcool etilico, pertanto l'acqua si scioglie (miscela) bene con queste sostanze.
Al contrario nell'olio (l'olio di oliva è principalmente formato da trioleina, trigliceride di acido oleico) le forze di interazione sono principalmente di tipo di van der Waals (e in misura minore di tipo dipolo-dipolo), come in generale per gli idrocarburi a catena lunga di questo tipo, pertanto si scioglierà bene in solventi apolari (pentano, esano, ottano, cicloesano, idrocarburi liquidi a catena corta C6-C9) e idrocarburi alogenati polari e non polari.
Quindi l'acqua e l'olio hanno differenti tipi di interazioni e tenderanno a non miscelarsi tra loro.
È meglio comunque tenere a mente che, mentre il legame idrogeno tende ad escludere le le altre interazioni, le altre interazioni sono meno repulsive tra di loro, almeno per molecole piccole e non polimeriche. Così l'acqua non si miscela con gli idrocarburi non polari privi di possibilità di legami idrogeno e con gli idrocarburi polari, mentre queste ultime due classi di composti sono miscibili tra loro in diversa misura. L'acqua si miscela bene invece con gli alcooli fino all'alcool butilico e nelle ammine a catena corta (fino C5, cinque atomi di carbonio).
Non mi risulta esista una tabella di "immiscibilità" delle sostanze, piuttosto esistono tabelle di miscibilità in acqua di vari solventi.
Qui di seguito riporto una tabella con indicato la miscibilità
con acqua di alcuni solventi, indicando il valore oppure una stima qualitativa
(poco solubile, insolubile), tenendo presente che un liquido insolubile
lascia comunque delle racce residue e che per poco solubile intendo
pochi grammi per litro d'acqua. Un composto miscibile in tutti i rapporti
viene indicato con il simbolo ![]() (infinito).
(infinito).
Miscibilità di alcuni solventi in acqua |
|
|
n-esano |
Immiscibile |
|
n-eptano |
Immiscibile |
|
n-ottano |
Immiscibile |
|
n-decano |
Immiscibile |
|
Toluene |
Immiscibile |
|
Benzene |
Immiscibile |
|
Cloro benzene |
Immiscibile |
|
Dicloro benzene |
Immiscibile |
|
Dicloro etano |
Immiscibile |
|
Trielina |
Immiscibile |
|
Olio di oliva (trioleina) |
Immiscibile |
|
Diclorometano |
Immiscibile |
|
Cloroformio (triclorometano) |
Poco solubile |
|
Tetraidrofurano |
Poco solubile |
|
Etere etilico |
Solubile / Poco solubile |
|
Metil-etil-etere |
Poco solubile |
|
Acetone |
|
|
Metil-etil-chetone |
Solubile |
|
Metanolo |
|
|
Etanolo |
|
|
Benzilico |
4g/100g acqua |
|
Terz-butanolo |
|
|
Alcool isopropilico |
|
|
Propanolo |
|
|
Butanolo |
7,9g/100g acqua |
|
Pentanolo |
2,3g/100g acqua |
|
Esanolo |
0,6g/100g acqua |
|
Fenolo |
Poco solubile / insolubile |
|
Xilene |
Immiscibile |
|
Etilbenzene |
Inmmiscibile |
|
Dietilammina |
Solubile |
|
Trietilammina |
Solubile |
|
Trimetilammina |
Solubile |
Bibliografia:
R.T.Morrison, R.N.Boyd "Chimica Organica", 5a ed.1991, Casa Editrice
Ambrosiana
S.Longhini, "Il libro della chimica", 1961 Garzanti
M.Nardelli "Introduzione alla chimica Moderna", 2a ed.1991, Casa Editrice Ambrosiana