Etimologia [1]1:
nel riportare le voci del dizionario
[…] indica che si sono omesse volutamente delle parti, (…, ndr9
indica aggiunte dello scrittore.
atomo: [à-to-mo]
s.m. 1 (chim., fis.) la particella più piccola
di un elemento capace di conservarne le caratteristiche chimiche, costituita
da un nucleo positivo intorno a cui ruotano delle cariche negative (elettroni)
2 (filos.) secondo l’atomismo antico, ciascuna delle particelle
minime indivisibili dalla cui aggregazione avrebbe origine ogni realtà
e la stessa essenza spirituale dell’uomo 3 (estens.) particella
o quantità piccolissima || Dal lat. atomu(m), e questo dal
gr. atomoV, propr. ‘indivisibile’, comp. di a- priv. e il
tema temnein ‘tagliare, dividere‘.
nucleo: [nù-cleo]
s.m. 1 La parte più interna o centrale di ql.co.;
[…] 2 (biol.) […] 3 (fis.) parte
centrale dell’atomo formata da protoni e neutroni 4 (astr.) […]
5 (geol.) […] 6 (fig.) […] || Dal
lat. nucleu(m), propr. ‘gheriglio della noce, nòcciolo’,
deriv. di nux nucis ‘noce’: cfr. nocciolo.
protone: [pro-tò-ne]
s.m. (fis.) particella elementare (in realtà composto
da quark, ndr) di carica elettrica positiva e massa circa duemila volte
più grande di quella dell’elettrone; con il neutrone è il
costituente fondamentale dei nuclei atomici [ill. Atomo] || Comp.
di proto- e -one.
neutrone: [neu-trò-ne]
s.m. (fis.) particella elementare (in realtà formata
da quark, ndr) priva di carica elettrica, di massa circa uguale a quella
del protone, costituente fondamentale del nucleo atomico [ill. Atomo]:
– lento o termico, in equilibrio termico con le particelle che lo circondano;
– pronto, emesso nell’istante in cui avviene la fissione nucleare;
– ritardato, emesso dopo un periodo di tempo misurabile dall’istante
della fissione || Comp. di neutro e –one.
elettrone: [e-let-trò-ne]
s.m. (fis.) particella subatomica elementare con carica
elettrica negativa | – di legame, elettrone in comune tra due o
più atomi [ill. Atomo] || Comp. di elettro- e one,
sul modello dell’ingl. electron; (dal greco electron, “ambra“,
[ndr]).
isotopo: [i-òò-to-po]
agg. e s.m. (chim.) si dice di elementi aventi lo
stesso numero atomico, cioè lo stesso numero di protoni, e uguali
proprietà chimiche, ma peso atomico differente in quanto differiscono
per il numero di neutroni: – radioattivo || dallingl. isotope
com. di ‘-iso-‘ (stesso, ndr) e il gr. topos ‘luogo’.
Stabilità dei nuclei
atomici [2], [4]
La stabilità di un nucleo
atomico formato da protoni e neutroni tenuti assieme da alcune interazioni
fondamentali2 è definita da un principio di esclusione
analogo al principio di esclusione di Pauli3 per gli elettroni
[3]. Come gli elettroni si collocano negli orbitali atomici seguendo questo
principio, così protoni e neutroni si posizionano su di livelli
progressivamente più energetici all’interno del nucleo, ciascun
livello con al massimo due protoni e due neutroni, con i livelli dei protoni
separati da quelli dei neutroni. Un nucleo come quello dell’elio possiede
quattro nuclidi (2 protoni e 2 neutroni) allo stato fondamentale, mentre
se fosse interamente composto da protoni avrebbe 2 nuclidi allo stato
fondamentale e 2 nuclidi in un livello maggiore di energia e quindi l’intero
nucleo sarebbe ad una energia maggiore. Quindi i nuclei con circa eguale
numero di protoni e neutroni sono più stabili.
Dal punto di vista chimico un
nucleo che possieda Z4 protoni [4] è caratterizzato
indipendentemente dal numero di neutroni, N presenti, e quindi in base
al numero di N sono possibili vari nuclei per uno stesso elemento: queste
specie atomiche vengono definite “isotopi”6.
E’ interessante notare che,
mentre per strappare un elettrone da un atomo occorrono energie differenti
a seconda dell’elemento considerato8, per strappare un nucleone
da un nucleo l’energia richiesta sia la stessa per tutti i nuclei degli
elementi (8,5 MeV); questo sancisce praticamente l’indipendenza di questa
energia da A e dipende dal tipo di interazione presente all’interno del
nucleo2.
Il rapporto tra protoni e neutroni
all’interno di un nucleo ed il numero ed il tipo di interazioni che si
stabiliscono tra essi stabilisce se questo nucleo sia o non sia stabile.
Escludendo l’idrogeno che è
assai peculiare5 gli altri nuclei degli elementi leggeri hanno
un rapporto (Fig.1) p/n tendente ad uno; i nuclei degli elementi pesanti
mostrano tutti un eccesso di neutroni che verrà spiegato in seguito,
noto come eccesso di massa.
|
H ¹ |
|
|
|
|
|
|
He 0.999 |
|
Li 0.761 |
Be 0.798 |
B 0.861 |
C 0.998 |
N 0.999 |
O 1.000 |
F 0.900 |
Ne 0.982 |
|
Na 0.917 |
Mg 0.975 |
Al 0.930 |
Si 0.994 |
P 0.939 |
S 0.996 |
Cl 0.921 |
Ar 0.820 |
[Fig.1]: Rapporti p/n per
gli elementi dei primi tre periodi, calcolati secondo l’equazione : p/n=
Z¸(M-Z), Z numero atomico, M mass atomica media
I protoni ed i neutroni sono
detti nucleoni (particelle formanti il nucleo) e ciascun nucleone è
in grado di stabilire interazioni con altri nucleoni; una coppia protone-neutrone
stabilisce una somma di interazioni stabili e bilanciate reciprocamente
(coppia deuteronica), mentre un eccesso o un difetto di neutroni nel nucleo
sbilancia il numero ed il tipo delle interazioni e pertanto il nucleo
risulta instabile. Solo quei nuclei che possiedono approssimativamente
lo stesso numero di protoni e di neutroni (rapporto p/n @ 1) risulta stabile
nelle condizioni attuali presenti sulla terra e pertanto ne costituiscono
la materia6 (Fig.1).
 Quei
Quei
nuclei che possiedono un rapporto tra p/n diverso da uno (p/n ¹ 1)
hanno vita media limitata rispetto ai loro isotopi più stabili.
Vari tipi di decadimenti radioattivi7 concorrono in tempi più
o meno lunghi alla trasformazione del nucleo instabile in una forma più
stabile. In pratica ponendo in un grafico con in ascisse il numero di
protoni ed in ordinata il numero di neutroni di un nucleo per gli elementi
della tavola periodica ed i loro vari isotopi otteniamo un grafico in
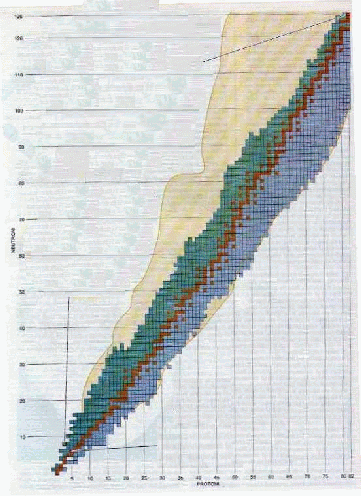
cui si individuano quattro zone (Fig.2).
Gli elementi che stanno sulla
diagonale marrone hanno tutti una stabilità nucleare elevata, mentre
quelli che si trovano sopra la diagonale (verde, eccesso di neutroni,
p/n<1) e sotto (azzurro, eccesso di protoni, p/n>1) sono legati,
ma instabili e soggetti a decadimento radioattivo. La quarta zona (zona
gialla)indica quei rapporti p/n che danno luogo ad un fenomeno prettamente
quantistico di dispersione della superficie nucleare in una sorta di alone
simile a quello in cui si trova l’elettrone in un orbitale; questa situazione
è altamente
[Fig. 2] Zone di stabilità
ed instabilità nel rapporto p/n dei
nuclei atomici (adattamento
da una immagine da [2])
instabile e solo di recente
i ricercatori sono stati in grado di studiarla [2].
Il motivo di questo tipo di
andamento risiede nelle interazioni nucleari che si stabiliscono fra i
nucleoni. L’interazione nucleare forte che lega fra di loro i nucleoni
è l’interazione maggiore presente all’interno del nucleo.
Tuttavia abbiamo già
accennato che essa possiede un raggio di azione estremamente limitato
(dell’ordine del fm) ed agisce quindi solo tra un nucleone e quelli strettamente
adiacenti. I protoni, al contrario dei neutroni, sono anche carichi positivamente
e tendono a manifestare una forza di repulsione quando sono posti in stretto
contatto. Poiché l’interazione elettrostatica, pur essendo più
debole, ha un raggio d’azione superiore a quella dell’interazione forte,
sono necessari alcuni neutroni che distanzino i protoni gli uni dagli
altri in modo che la repulsione elettrostatica venga compensata dall’aumento
di interazione forte che si viene a creare tra i protoni ed i neutroni.
Per il principio di esclusione di Pauli un nucleo formato da due protoni
e da due neutroni è più stabile sia di uno formato da quattro
protoni sia di uno formato da quattro neutroni.
Tuttavia all’aumentare del numero
di protoni, la repulsione elettrostatica rende necessario un leggero eccesso
di neutroni e per questo il rapporto p/n si discosta dall’unità
per molti nuclei stabili. Il limite di questa stabilità è
dato dall’elemento con Z=92 (uranio, U) che possiede 146 neutroni9,
dopodiché in natura non esistono nuclei stabili in condizioni normali;
gli elementi con Z>92 (transuranici) sono artificiali e sono instabili.
Per sapere quali nuclei siano
allora stabili occorre calcolare il potenziale medio a cui è soggetto
ciascun nucleone; dai calcoli emergono configurazioni particolarmente
stabili e si scopre persino che i nucleoni tendono ad aggregarsi all’interno
del nucleo in particelle alfa [4]. Queste configurazioni danno origine
a nuclei atomici sferici e sono caratterizzati da un A che segue la sequenza:
2, 8, 20, 28, 40, 50, 82, 126, 184, chiamati numeri “magici”
per la peculiare stabilità che conferiscono al nucleo. Un numero
differente di A produce nuclei sferoidali (oblati, prolati, triassiali)
instabili. Un elemento con più di un numero “magico”
(es: 16O, otto protoni ed otto neutroni, 208Pb,
82 protoni, 126 neutroni) sono particolarmente stabili [6].
Aspetti peculiari dei
modelli nucleari:
I fisici di tutte le epoche
si sono cimentati nell’immaginare, pensare, ideare, modelli che descrivessero
la materia che costituisce l’universo. Ricordo che sorridevo quando studiavo
i primi goffi tentativi di descrizione della realtà tentati dai
filosofi antichi come il modello basato sull’acqua di Talete (624-545
a.c), gli enti numerici pitagorici, gli atomi democritei (Democrito 470-380
a.C.), le teorie sui quattro elementi degli alchimisti medievali, fino
ai moderni corpuscoli newtoniani (1642-1727), particelle leibniziane (1646-1716);
i primi fisici moderni settecenteschi, ottocenteschi e novecenteschi,
la teoria atomica di Dalton (1808), il modello a panettone di Thomson
(1897), quello planetario di Rutherford (1911), il modello orbitalico-quantistico
di Bohr (1913), il modello ondulatorio di Scroedinger (1925), pare che
tutti abbiano voluto dare il loro contributo dando libero sfogo alla loro
immaginazione (acqua, fuoco, pianeti, panettoni, onde).
Ci si aspetterebbe che la moderna
scienza sorrida di fronte a questi modelli rozzi, invece anche i fisici
moderni (nel XX secolo) adottano modelli pratici desunti dall’esperienza
quotidiana: per il nucleo atomico c’è il cosiddetto modello “a
goccia d’acqua” mentre per l’atomo c’è il modello “a
bolla di sapone” !
Il fatto sorprendente è
che questi modelli a base di acqua funzionano bene; forse Talete aveva
davvero compreso la materia con quasi tremila anni di anticipo, quando
affermava che tutto è fatto d’acqua.
Note:
-
I numeri tra parentesi quadre,
“[1]”, si riferiscono ai richiami bibliografici, quelli
tra parentesi tonde, “(Fig.2)”, si riferiscono alle figure,
quelli all’apice, “3“, alle note al testo. -
Le forze che interagiscono
con la materia sono quattro: interazione forte (Yukawa, 1935), interazione
debole (Fermi, 1933), interazione gravitazionale (Newton, 1686), interazione
elettromagnetica (Maxwell, 1864); all’interno del nucleo sono presenti
tutte e quattro in ordine di energia: i. forte > i. elettromagnetica
> i. debole > i. gravitazionale [5]. -
Il principio di esclusione
(1925) di Pauli (Wolfgang, 1900-1958) che è una peculiarità
della meccanica quantistica e non trova alcun riscontro nella meccanica
classica stabilisce che gli elettroni di un atomo stabile allo stato
fondamentale siano tutti in stati energetici differenti; dato che
in ogni orbitale possono esserci al massimo due elettroni, questi,
se presenti entrambi, avranno spin opposti [3]; in questo modo Pauli
ipotizza un quarto numero quantico. Questo principio ha come conseguenza
impenetrabilità dei corpi per repulsione elettronica. -
Il numero atomico, Z indica
il numero di protoni all’interno del nucleo atomico, mentre N è
il numero di neutroni; il numero A=Z+N, si dice numero di nucleoni. -
La forma stabile dell’idrogeno
possiede solo un protone nel nucleo (1H, l’indice 1 non
si riferisce ad una nota ma indica il numero di nucleoni A), mentre
i suoi isotopi, il deuterio (D, oppure 2H) ed il trizio
(T, 3H), sono instabili e radioattivi. -
Le abbondanze relative dei
vari isotopi eludono dallo spazio di questa risposta ma si possono
reperire nei testi di chimica. -
Il decadimento “beta”
(b) produce un elettrone ed un protone partendo da un neutrone e di
il nucleo si ritrova con un protone in più, mentre il decadimento
“alfa” (a) produce particelle composte da due protoni e
da due neutroni strappati dal nucleo che si ritrova con due protoni
e due neutroni in meno; il decadimento “gamma” (g) si manifesta
ad energie di eccitazione maggiori ed ha come conseguenza la rottura
del nucleo in una reazione a catena. -
Questa energia per strappare
un elettrone da un atomo neutro si chiama “energia di prima ionizzazione”
(E1); in seguito a ionizzazioni successive si definiscono energie
di seconda, terza, n-sima ionizzazione, con E1<E2<E3<En,
ed è una delle caratteristiche salienti degli elementi e ne
definisce in un certo modo la reattività chimica. Il cesio
(Ce) ha l’E1 minore, mentre il fluoro ed i gas nobili hanno E1 maggiori. -
238U, (A=238),
salito alla ribalta di recente a causa dell’utilizzo di proiettili
all’uranio impoverito durante il conflitto nei Balcani 1996-2000.
Bibliografia:
[1] IL GRANDE DIZIONARIO GARZANTI
della lingua italiana, Garzanti (1987)
[2] S.M.Austin, G.F.Bertsch,
LE SCIENZE n.324 (ago. 1995)
[3] Enciclopedia Cronologica
delle scoperte e delle invenzioni, G.Rivieccio, Rusconi (1995)
[4].ATOMI E NUCLEI ( a cura
di C. Bernardini) LE SCIENZE quaderni n 43 (sett. 1988)
[5]. La nuova enciclopedia delle
scienze Garzanti, Garzanti (1988)
[6]. Fisica 1, Resnik, Halliday,
Krane, Ambrosiana (1993), 4a edizione